МЕТАЛЛЫ ЖИЗНИ
Сравнительно давно уже было известно: полное отсутствие металлов в рационе ведет к тяжелым и даже гибельным заболеваниям. Чем же обусловлено столь важное значение металлов для жизнедеятельности! Какую роль играют они в биохимических процессах! В протекании каких конкретных реакций участвуют!
Об этом в беседе с нашим специальным корреспондентом рассказывает академик АН УССР Константин Борисович ЯЦИМИРСКИЙ, директор Института физической химии АН УССР имени Л. В. Писаржевского.
КОГДА ВСКРЫЛИ АМПУЛЫ...
Разнообразие веществ живой природы огромно: одни только белки исчисляются тысячами. А между тем все это богатство создано из весьма однотипного сырья. Вглядитесь в формулы органических соединений: цепочки букв С, по бокам — Н; да кое-где — О и N. Четыре этих элемента — углерод, водород, кислород, азот — почти нацело представляют собою химический состав живых организмов.
Возьмем, к примеру, организм человека: атомы водорода составляют 63 процента от общего числа входящих в него атомов, атомы кислорода — 25,5 процента, атомы углерода — 9,5 процента, атомы азота— 1,4 процента. В сумме получается 99,4 процента. Из всех прочих элементов в мягких тканях человеческого организма по большей части представлены неметаллы.
Эти цифры наводят на мысль, что металлы не играют существенной роли в жизненных процессах. Однако такой вывод был бы в корне .неверен. Полное отсутствие металлов в рационе приводит к тяжелым и даже гибельным заболеваниям.
Недавно профессор Ф. Эгами (Япония) провел любопытный эксперимент. Он заполнял ампулы морской водой такого состава, который она имела в пору зарождения жизни на Земле. Рецепт соответствовал геологическим данным, и только содержание шести металлов (цинка, молибдена, железа, меди, марганца, кобальта
) было повышено в десятки тысяч раз. В воде были также растворены гидроксиламин и формальдегид — два сравнительно простых вещества, которые с большой вероятностью образовывались в земной атмосфере древнейших времен при иэвержениях вулканов, от грозовых разрядов и т. д. ) Свободное пространство в ампулах было заполнено азотом. Раствор выдерживался , до нескольких месяцев при нагреве до 1 105°С: высокая температура ускоряла течение химических процессов, а также исключала присутствие микроорганизмов.Когда ампулы вскрыли, в воде были обнаружены несколько важнейших для жизни аминокислот: глицин, аланин, серии, глутамин, аспарагин, пролин...
IВ этом убедительном эксперименте ме таллы заявляют о себе как организаторы
J жизни. Объяснить это в самых общих чертах можно с помощью весьма элементарных соображений.МЕТАЛЛЫ СВЯЗУЮЩИЕ И РАСТОРГАЮЩИЕ
Жизнь — это непрерывная последовательность многообразных актов объединения и распада органических молекул.
Остов каждой молекулы образуют ядра атомов, из которых она состоит. Внешние электронные оболочки этих атомов обобществляются (в этом, грубо говоря, и заключается образование химической связи) и образуют единое для всей молекулы электронное облако.
Представим себе, что в непосредственной близости от органической молекулы оказался ион металла — атом, лишенный одного или нескольких внешних электронов и потому заряженный положительно. Может случиться, что он частично перетянет на свои вакантные электронные оболочки электроны одного из атомов, входящего в состав молекулы, и таким образом свяжется с нею. Если он совершит подобное с двумя молекулами, то они благодаря ему окажутся сцепленными.
Возникшая связь может перестроиться так, что обе молекулы, поначалу сцепленные ионом металла, соединятся напрямую, а ион освободится, готовый соединить следующую пару молекул.
Возможен, однако, другой исход подобного процесса. Для атома, предоставляющего иону металла свои электроны, это может оказаться выгоднее с энергетической точки зрения, чем отдать их в общее электронное облако молекулы. Тогда его прежняя связь с молекулой порвется, и он вступит в новую связь с ионом металла. Примерно по такому механизму и начинается разрушение органических
молекул, когда работу разрушителя выполняет ион металла. Правда, в таких случаях он выступает не в одиночку, а в составе белковой молекулы фермента. Белковое окружение многократно (иногда в миллиарды раз!) повышает его производительность.Надо сказать, что фрагменты разрушенных молекул не способны к длительному существованию (те из них, которые имеют неспаренный электрон, химики недаром называют короткоживущими свободными радикалами). Они активно стремятся к восстановлению разорванных химических связей. Возможности для этого разнообразны. Может случиться, что один фрагмент встретится с другим и соединится с ним. А может произойти нечто более интересное: радикал подойдет к какой-нибудь молекуле, оторвет от нее подходящий для воссоединения фрагмент, затем остаток разорванной молекулы совершит то же самое со следующей молекулой, и таким образом начнется длительный многоступенчатый процесс, называемый цепной реакцией. Подобные процессы нередко протекают в живой природе, и их инициаторами зачастую выступают ионы металлов, способные разрывать молекулы на радикалы.
Ионы металлов могут побуждать органические молекулы к объединению и разрыву, даже и не вступая с ними в связь. Дело в том, что у многих молекул электронное облако довольно несимметрично— скажем, смещается к одному ее концу, оголяя другой. Так на одном конце молекулы возникает избыток отрицательного заряда, а на другом — избыток положительного. Такие молекулы называются полярными. Если к ним приближается ион металла, они поворачиваются и притягиваются к нему своим отрицательно заряженным концом. В процессах биосинтеза полярные молекулы описанным способом берутся на буксир и доставляются к месту сборки, разворачиваются и устанавливаются на нужные места. Таким же образом отходы биологического производства выводятся из организма.
Стоит учесть еще вот что: ион металла, приблизившись к отрицательному концу полярной молекулы, сильнее оттягивает к нему электронное облако, силовое взаимодействие между разделенными зарядами на концах молекулы возрастает, и молекула активируется, то есть у нее увеличивается запас внутренней энергии. А химикам известно, что, лишь обладая им в достаточной мере, молекула способна вступать в реакции.
Итак, с помощью ионов металлов налаживаются и расторгаются химические связи, транспортируются и активируются биомолекулы.
Кто сможет после сказанного умалить роль металлов в
жизненных процессах?Разумеется, в описанных выше процессах хорошо работают не все, а лишь строго определенные металлы. Какие же именно
?ПЕРВАЯ ДЕСЯТКА
В организме человека (как и в организмах других животных и в растениях) тонкими методами химического анализа можно обнаружить около 70 элементов, усваиваемых вместе с водой, пищей и воздухом. Однако большинство из них вряд ли играет какую-нибудь определенную роль в биохимических процессах.
Вопрос о биологической значимости того или иного элемента можно выяснить только после того, как будет установлено, в состав каких биомолекул он входит и какие функции там выполняет.
Выяснение биологических функций ионов металлов на атомно-молекулярном уровне представляет собой главную задачу бионеорганической химии (по-иному — неорганической биохимии). Эта наука возникла недавно, в начале 60-х годов, и в сан “металлов жизни” она возвела пока лишь десять элементов, биологическая роль которых неоспорима. О них и пойдет речь в статье. Несомненно, к их лику в ближайшем будущем потере
развития неорганической биохимии будут причислены новые металлы. Но сейчас — о десяти. Это натрий, калий, магний, кальций, железо, цинк, медь, кобальт, марганец, молибден.Наш рассказ о них, стесненный рамками статьи, будет фрагментарным, но довольно точным: желая охарактеризовать биохимическую индивидуальность каждого, мы будем опираться на цифры, сведенные в таблице. Они показывают, насколько прочные химические связи способны образовывать перечисленные металлы.
В таблице две колонки. Они соответствуют двум основным типам химической связи - ионной и ковалентной. Оба понятия пояснены в подписи под таблицей, здесь же ограничимся замечанием: в подавляющем большинстве случаев ионная связь и образуется и рвется гораздо быстрее, чем ковалентная (характерное время образования и разрушения первой — тысячные и даже миллионные доли секунды, второй — минуты).
В таблице, кроме ионов, необходимых для жизнедеятельности, перечислены некоторые другие. Они имеют точно такое же строение внешних электронных оболочек и тем не менее вредны для организма. Это бериллий, ртуть, кадмий, свинец.
Числа таблицы сразу раскрывают причину их токсичности: они образуют слишком прочные, трудно расторжимые связи. А ведь жизнь, “как уже говорилось,— это последовательность актов объединения и распада. Соединения, неспособные к распаду, не могут быть участниками жизненных процессов—и потому те металлы, которые намертво скрепляются со своими партнерами по химической связи, не могут войти в число “металлов жизни”.
Вглядевшись в таблицу внимательнее, читатель обнаружит в ней элементы, очень близкие и по прочности образуемых связей и по химическим свойствам. Значит ли это, что они взаимоизменяемы в биологических системах? Например, эксперименты доказывают, что функции цинка во многих случаях и даже с большим успехом мог бы выполнить кобальт. Очевидно, природа предпочла цинк потому, что кобальта на планете гораздо меньше (в десятки раз).
В некоторых случаях цифровое сходство может оказаться обманчивым. Например, судя по таблице, кальций и стронций очень похожи друг на друга. Но если в костной ткани ионы кальция заменяются чуть более крупными ионами стронция, структура ткани получается более рыхлой, кости становятся ломкими и искривляются. Таковы симптомы странной болезни, которая поразила переселенцев, обосновавшихся в начале века на дальневосточной реке Уров. Причину заболевания разгадал академик А. П. Виноградов, много изучавший значение металлов для живых организмов. Оказалось, что в почвах злополучного района чрезмерно много стронция и мало кальция.
Разгадка уровской болезни и решение вопросов общего характера, затронутых нами до сих пор, своей кажущейся простотой могут ввести читателя в заблуждение. В бионеорганической химии отнюдь не все так просто. У этой молодой науки еще много нерешенных проблем. И не случайно в дальнейшей нашей беседе о “металлах жизни” загадочные факты и ждущие проверки гипотезы будут встречаться чаще, чем обоснованные объяснения описываемых явлений.
КАЛИЙ, НАТРИЙ
Ионные связи, образуемые этими элементами, непрочны, а ковалентных ни натрий, ни калий не образуют вовсе. Так что и в клетках и во внеклеточных областях они находятся в основном в виде свободных ионов.
Ион натрия почти в полтора раза меньше иона калия и в условиях лабораторного эксперимента легче диффундирует сквозь клеточные мембраны. Казалось бы, так оно должно быть и в организме, и потому внутри клеток натрий должен преобладать по сравнению с калием.
Так нет же! Калий в организме находится главным образом внутри клеток, а натрий во внеклеточных областях. Скажем, в кровяных клетках калия в 10,5 раза больше, чем натрия, а в плазме крови, наоборот, почти в 30 раз меньше. Только при гибели организма внутри и вне клеток устанавливается такое распределение этих ионов, которое соответствует их коэффициентам диффузии.
Удовлетворительно объяснить это явление еще не удалось никому. А вот зачем нужно столь резкое различие в концентрациях, понятно. Благодаря ему возникает разность электрических потенциалов между жидкостями внутри и вне клеток, создаются условия для передачи нервных импульсов (заметим, что в нервной сигнализации участвуют также ионы кальция и магния, речь о которых впереди).
В гипотезах о биохимической природе нервно-мозговой деятельности человека натрию и калию отводится значительное место. Возьмем известное деление памяти на два типа: короткую и продолжительную. Например, записывая текст под диктовку, вы запоминаете каждое слово лишь на те несколько секунд, за которые пишете его. Это короткая память. Заучивая тот же текст наизусть, вы твердите фразу за фразой по нескольку минут, вырабатывая продолжительную память.
Считается, что механизм кратковременной памяти имеет ионную природу (оттого и коротка она: ведь ионные связи разрушаются быстро) и главную роль в нем играют ионы натрия и калия. Гипотезы о долговременной памяти утверждают, что она связана с образованием сравнительно устойчивых белковых структур.
Обнаружено, что ионы натрия и калия могут замещаться на еще меньшие по размеру ионы лития, незначительное присутствие которых в организме человека благотворно влияет на нервно-мозговую деятельность.
МАГНИЙ
Как уже говорилось, природа старается строить живые организмы из наиболее доступного сырья. Магний именно таков: его много в любой воде (это один из факторов ее жесткости), из содержащих его минералов (доломита, магнезита) сложены целые горы.
Еще в пребиотический период (то есть во времена, непосредственно предшествовавшие появлению жизни на Земле в ее современных формах) магний играл огромную роль в создании первых живых систем. Важное значение сохранил он и в организмах, существующих ныне. Благодаря каким же достоинствам?
Ион магния мал и потому в ионные связи вступает прочно. Он образует надежные ионно-ковалентные связи со всеми группами атомов, содержащими кислород, и несколько более слабые — с аминогруппой
NH2. Вспомним, как в начале статьи говорилось про то, каким образом ион металла способен скрепить несколько органических молекул. Чаще всего в подобных случаях роль соединительного звена исполняет именно ион магния.Установлено, что рибосомы распадаются, если из них удалять магний, на неравные половинки; эти субъединицы объединяются вновь с добавлением магния, с дальнейшим же его удалением рибосомы уже необратимо теряют свою структуру.
Магний входит в состав некоторых ферментов, его ионы регулируют многие процессы обмена веществ в организме животных
in человека (в частности переработку углеводов).Исключительно важна его роль в мире растений: порфириновый цикл с магнием в центре (см. рис.
1) — основа молекулы хлорофилла. Однако эта роль магния еще не выяснена. Нетрудно заменить его в порфириновом цикле на кобальт, цинк или железо. Но после этого хлорофилл уже не способен участвовать в фотосинтезе. Почему? Еще неизвестно.КАЛЬЦИЙ
В первой главе статьи, где говорилось о мизерном содержании металлов в организме человека, читатель, вероятно, обратил внимание на оговорку: “...в мягких тканях организма”. Из разговора, таким образам, исключались кости и зубы. Арматуру костной ткани составляют кристаллы гидроксиапатита, соли кальция. В теле человека, весящего 70 килограммов, кальция содержится примерно полтора килограмма.
Поскольку роль костей чисто механическая, то с точки зрения биохимии содержащимся в них кальцием, казалось бы, можно пренебречь. Однако в последнее время обнаружилось, что он находится в состоянии непрекращающегося обмена с кальцием, выполняющим в организме другие функции,— скажем, содержащимся в крови. И хотя здесь его в сотню раз меньше, чем в костях, его концентрация поддерживается с помощью особого гормона, выделяемого паращитовидной железой на строго постоянном уровне, понижение которого влечет обморочное состояние. Такая бдительность неспроста: ионы кальция ответственны за свертывание крови, участвуют 8 обмене веществ и других процессах, изучение которых только начинается.
По прочности ионных и ковалентных связей кальции уступает магнию. Например, присоединиться к аминогруппе он не может, зато способен образовать ионную связь с кислородом.
Предполагают, что на этой его способности основан механизм сокращения и расслабления мышц. Согласно гипотезе, в состоянии расслабления белковые молекулы, входящие в состав мышечных клеток, увешаны ионами кальция, присоединившимися к атомам кислорода. В силу своего одинакового заряда эти ионы отталкиваются друг,<от друга и растягивают молекулу, на которой сидят, что и выражается в расслабленном состоянии мышцы.
Когда же из мозга в мышечные клетки поступает сигнал на сжатие, он влечет за собой в первую очередь повышенную концентрацию фосфат-ионов во внутриклеточной жидкости. С ними ионы кальция соединяются прочнее, чем с атомами кислорода, и благодаря этому осыпаются с белковых молекул, позволяя им (а стало быть, и всей мышце) сжаться.
ЖЕЛЕЗО
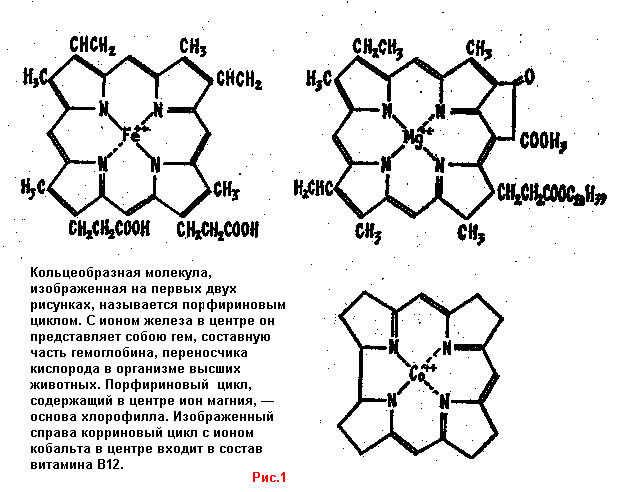
Вряд ли стоит распространяться, сколь важен этот элемент для человеческого организма; каждому известно, что железо входит в состав крови. Здесь на него возложена важнейшая биологическая функция—перенос и активирование молекулярного кислорода.
Говоря точнее, эту функцию выполняют железосодержащие белки — миоглобин, гемоглобин и гемеритрин. Первые два имеют в своем составе так называемый гем (см. рисунок) — порфириновый цикл, в центре которого находится ион железа. Этот ион обладает зарядом +2, но способен перейти в состояние с зарядом +3, отдав один электрон. Так оно и происходит в легких, когда к нему присоединяется молекула кислорода. Приняв один электрон, она переходит в активное состояние, готовая принять участие в различных окислительных процессах, идущих в клетках.
Здесь следует подчеркнуть одно счастливое обстоятельство. Ион железа в геме не может иметь заряд, превышающий +3, и потому способен передать молекуле кислорода только один электрон. Если бы это было не так и молекула кислорода получила электроном больше, она перешла бы в менее активное состояние и не смогла бы оказывать окисляющее действие во многих биохимических реакциях, где предполагается участие кислорода.
Узнав про это, естественно полюбопытствовать: а что если молекула кислорода по дороге из легких к месту назначения получит нежелательный лишний электрон от какой-то встречной молекулы или иона? Чтобы этого не случилось, в гемоглобине гем снабжен “довеском”, который тяжелее его в сто раз,— глобином.
Этот биополимер одним своим участком присоединяется к иону железа; изгибаясь дугой, он другим своим участком подходит к иону железа с противоположной стороны и притом на такое расстояние, чтобы образовавшийся зазор был в точности необходим и достаточен для размещения .молекулы кислорода: в таком гнезде ей обеспечено надежное прикрытие.
Но это еще не все. Отмеченные выше участки молекулы глобина несут пятизвенное кольцо из трех атомов углерода и двух атомов азота — так называемый имидазол. Имидазольное звено, соединенное с ионом железа, активизирует его, способствует его соединению с молекулой кислорода. Другое имидазольное звено, прикрывающее собою молекулу кислорода, поляризует ее и тем самым дополнительно закрепляет ее на месте.
Сходным образом устроен и миоглобин. В гемеритрине молекула кислорода находится между двумя атомами железа, также связанными с белковыми “привесками”.
Железо относится к числу переходных металлов. Атомы этих элементов способны в большом числе собираться в крупные образования
— кластеры. Если один ион железа с зарядом +2 может отдать лишь один электрон, то кластер железа одновременно сразу несколько электронов. Такое бывает необходимо в биохимических процессах. Поэтому, в частности, мы и встречаем железо в составе многих ферментов — каталазы, перокеидазы, цитохромов и других.ЦИНК
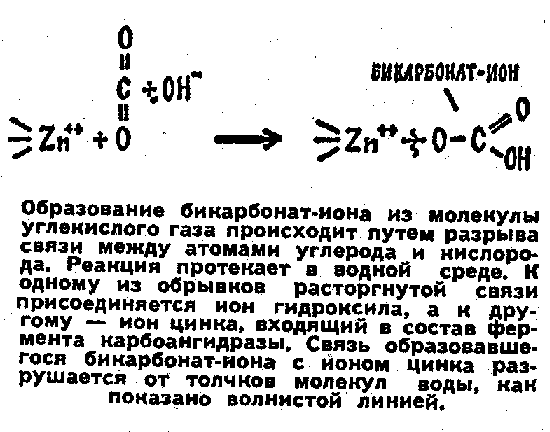
Рисунок на этой странице заставляет нас вспомнить начало статьи, где говорилось, как ион металла разрушает межатомные связи. В приведенном здесь примере (см. рисунок) разрушителем связи между атомами углерода и кислорода выступает ион цинка.
Обратите внимание: реакция протекает в воде, ее молекулы здесь не посторонние. Цинк участвует во многих подобных реакциях разложения органических веществ в водной среде — реакциях гидролиза. Например, он незаменим в гидролизе пептидов: только он способен разорвать характерные для этих соединений связи между атомами углерода и азота.
Гидролитическая активность цинка основана на его высокой способности к образованию ковалентных связей. Соединяться с собою он заставляет не только атомы кислорода и азота, но даже и атомы серы.
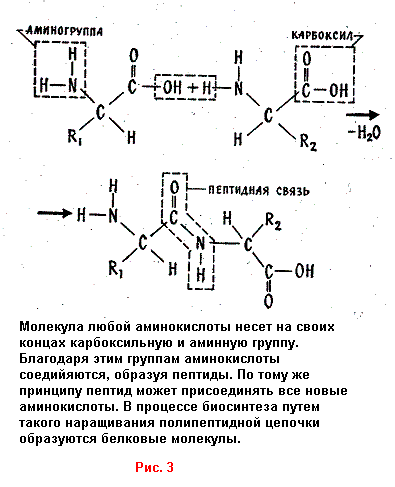
Любопытно: если какой-то ион разрушает определенную межатомную связь при разложении биомолекул, то он же участвует и в образовании .этой связи в процессе биосинтеза. Так, ион цинка необходим для налаживания так называемой пептидной связи, где углерод соединяется с азотом (см. рисунок). Именно благодаря ее возникновению из аминокислот составляются белковые молекулы. Вот почему в зонах интенсивного деления клеток всегда наблюдается повышенная концентрация цинка, а недостаток этого металла в рационе замедляет рост.
МЕДЬ
Каждый слышал, пожалуй, что соединения меди ядовиты. Ее токсическое действие объясняется тем, что она образует слишком прочные связи с атомами серы, входящей в состав таких важных соединений, как цистин, цистеин, альбумин и т. д. А ведь, как уже говорилось, в биохимических реакциях в живом организме не может участвовать элемент, который мертвой хваткой вцепляется в молекулу партнера.
Почему же, несмотря на это, медь входит в число “металлов жизни”?
На первый взгляд ее успешно мог бы заменить цинк. Его способность к образованию ионных и ковалентных связей выражается такими же числами, как и у меди (см. таблицу). Но цинк образует комплексные соединения лишь тетраэдрической, редко октаэдрической формы, а многие важные для организма биокомплексы, образованные ионами двухвалентной меди, имеют структуру квадрата или четырехгранной пирамиды.
К тому же, участвуя в биохимических реакциях, цинк всегда сохраняет свою валентность, а участие в них меди на том и основано, что она то и дело меняет свои возможные состояния — одновалентное (с зарядом +1) и двухвалентное (с зарядом
+ 2).Казалось бы, в этой роли ее могло бы заменить железо, способное переходить из двухвалентного в трехвалентное состояние и обратно. Нетрудно показать, однако, что такая замена для организма была бы неравноценной. У меди более низкий, чем у железа, окислительно-восстановительный потенциал, говоря проще, одновалентная медь активнее навязывает свои электроны молекулам, если это требуется по программе той или иной биохимической реакции” Именно благодаря этому медь, например, незаменима там, где требуется разрывать или образовывать связи между атомами углерода и серы.
Неповторимая химическая индивидуальность меди причиной тому, что мы встречаем ее в организме в составе многих металлсодержащих белков — таких, как тирозиназа, лакказа, церулоплазмин, аминооксидаза, азурин и другие.
КОБАЛЬТ
За разговором о цинке и меди мы отмечали, что с помощью этих металлов рвутся и налаживаются связи атомов углерода с атомами кислорода, азота и серы.
Резонно поинтересоваться: а как обстоит дело с разрушением и образованием связей “углерод-углерод”? Оказывается, ни один из разбиравшихся до сих пор “металлов жизни” не может справиться с этой связью. А между тем взгляните хотя бы на рисунок, где изображен гем: сколько подобных связей необходимо создать при синтезе этой молекулы!
Здесь в созидательной роли незаменим кобальт. Читатель, наверное, слышал, что он содержится в витамине
B12, необходимом для кроветворения (см. рис. 1).МАРГАНЕЦ
Ион этого элемента с зарядом +2 очень близок по своим свойствам к иону магния того же заряда и может заменять его во многих биохимических процессах. Возможность такой замены поставила перед учеными немало любопытных вопросов.
Возьмем, например, синтез ДНК. Когда он проходит с участием одного лишь магния, дело идет медленно, но безошибочно. Участие марганца сильно ускоряет процесс, но в этой спешке делается много сбоев, следствием которых порою могут быть различные уродства.
С одной стороны, из-за этого природа не должна бы использовать марганец. Но, с другой стороны, генетические сбои — источник мутаций, столь необходимых для естественного отбора, давшего высшие формы жизни!
Вот и судите, стоило ли природе предпочесть магний марганцу?
Кстати, в последнее время в организмах высших животных обнаружено еще немало ферментов (кроме ДНК-полимеразы, затронутой выше), где марганец не может быть заменен магнием. Недаром полное отсутствие марганца в рационе животных приводит к их гибели.
Напомним, что у марганца атом тяжелее, чем у магния, у него выше заряд, больше электронов. Сравнение заставляет предполагать, что в процессе биологической эволюции по мере усложнения организмов и их функций в их состав включались элементы со все более сложными электронными оболочками, видимо, способные на такие проявления, которые непосильны их “меньшим братьям” по менделеевской таблице.
МОЛИБДЕН
Свою важнейшую биохимическую роль молибден выполняет, входя в состав растений и микроорганизмов, которые фиксируют атмосферный азот, то есть переводят его из свободного в связанное состояние (см. “Наука и жизнь” № 6, 1975, стр. 14—21; № 9, 1978, стр. 18—19). Если учесть, что азот входит в состав каждой аминокислоты, значение молибдена для жизни на Земле представится поистине неоценимым.
Как и у всякого “металла жизни”, у молибдена есть свои уникальные функции и в человеческом организме. Например, он незаменим при переработке спиртов на той стадии, когда образуется альдегид и его надо окислить (иначе он отравит организм).
ВАНАДИЙ, ХРОМ, НИКЕЛЬ...
По традиции, восходящей к В. И. Вернадскому, все химические элементы, входящие в состав живых организмов, принято делить на три группы
.Во-первых, макроэлементы, содержание которых превышает сотые доли процента. В ряду “металлов жизни” это кальций, магний, натрий, калий.
Во-вторых, микроэлементы, содержание которых измеряется' величинами от сотых до стотысячных долей процента. К их числу относятся шесть остальных из разобранных нами биоактивных металлов.
В-третьих, ультрамикроэлементы, содержащиеся в организмах в еще меньших количествах. Наличие некоторых из них в организме, по всей видимости, не случайно: речь идет про ванадий, хром, никель, олово и литий.
Первые три из этой пятерки активируют многие ферменты; в больших концентрациях эти элементы токсичны. Роль олова неясна, но твердо установлено, что оно в виде оловоорганических соединений аккумулируется в центральной нервной системе. О роли лития в психической деятельности человека упоминалось за разговором про натрий и калий.
Такие ультрамикроэлементы, как бор, алюминий, титан, стронций, кадмий, по-видимому, станут предметом дальнейшего внимания бионеорганической химии. Наука это молодая .и быстро развивающаяся; у тех, кто посвятит себя ей, впереди еще немало работ и, несомненно, немало открытий.
ЛИТЕРАТУРА
ВОЙНАР А. О. Биологическая роль микроэлементов в организме животных и человека, 2-е изд. М., “Высшая школа”, 1960.
Неорганическая биохимия (ред. Г. Эйхгорн). Пер. с англ., т. 1—2, М., “Мир”, 1978.
УИЛЬЯМС Д. Металлы жизни. Пер. с англ., М„ “Мир”, 1975.
ЯЦИМИРСКИЙ К. Б. Введение в бионеорганическую химию. Киев, “Наукова думка”, 1976.