ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ
Все белки различаются по своей первичной структуре.
Установление первичной структуры белка служит основой для определения вторичной
и третичной структур, выяснения расположения функциональных групп в его
активном центре и открывает путь к познанию механизма его функционирования.
Первичную структуру белков можно
определять путем непосредственного анализа аминокислотной последовательности
или путем расшифровки нуклеотидной последовательности соответствующих генов с
помощью генетического кода.
При записи последовательности
аминокислот в полипептидных цепях используется однобуквенное или трехбуквенное
сокращение и предполагается, что a-аминогруппа находится слева, а a-карбоксильная группа — справа от символа, т. е.
полипептидная цепь начинается с остатка, имеющего свободную a-аминогруппу, и заканчивается остатком, имеющим
свободную карбоксильную группу. Аминокислотные остатки—называются
соответственно N-концевым и С-концевым остатком.
В качестве примера использования
сокращенной символики и для демонстрации ее преимуществ приведены структуры
гормона вазопрессина, который производится гипофизом и регулирует кровяное
давление, сужая капилляры и усиливая ресорбцию воды в почках.
Cys-Tyr-Phe-Gln-Asn-Cys-Pro-Arg-Gly-NH2 или C YFQNCPRG-NH2
|
|
|
|
а) б)
Рис. 1. Молекула вазопрессина:
а)—записанная с помощью
трехбуквенной символики; б)— записанная с помощью однобуквенной
символики. Линия, соединяющая символы остатков цистеина в формуле, означает
наличие между ними дисульфидного мостика; С-концевая карбоксильная группа
аминокислоты амидирована
Исследование первичной структуры белка
начинается с определения его молекулярной массы, аминокислотного состава, N- и С-концевых аминокислотных остатков. Поскольку пока
не существует метода, позволяющего
установить полную первичную структуру белка на целой молекуле, полипептидную
цепь подвергают специфичному расщеплению химическими реагентами или
протеолитическими ферментами. Смесь образовавшихся пептидных фрагментов
разделяют, и для каждого из них определяют аминокислотный состав и
аминокислотную последовательность. После того как структура всех фрагментов
установлена, необходимо выяснить порядок их расположения в исходной полипептидной
цепи. Для этого белок подвергают расщеплению при помощи другого агента и
получают второй, отличный от первого набор пептидных фрагментов, которые
разделяют и анализируют аналогичным образом.
Предположим, что исследуемый модельный
полипептид имеет последовательность представленную на рис.2. При действии на
него трипсином гидролизуются связи: Lys-Val и Arg-Ser, а при
обработке бромцианом (BrCN) расщепляются связи: Met-Tyr и Met-Ala.
Бромциановые пептиды
|
Ala-Val-Met |
|
Туг-Asn-Lys-Val-Ile-Gly-Ser-Met |
|
Asn-Phe-Arg-Ser-Glu-Val |
Триптические ïåптиды
|
Ala-Val-Met Туг-Asn-Lys |
|
-Val-Ile-Gly-Ser-Met Asn-Phe-Arg |
|
Ser-Glu-Val |
Полная аминокислотная последовательность модельного
полипептида
|
Ala-Val-Met-Tyr-Asn-Lys-Val-Ile-Gly-Ser-Met-Asn-Phe-Arg-Ser-Glu-Val |
Рис.2
Сопоставление аминокислотных
последовательностей бромциановых и триптических пептидов позволяет однозначно
выяснить их расположение вдоль полипептидной цепи белка. Обычно для определения
полной структуры белка двух гидролизатов оказывается недостаточно, причем чем
длиннее полипептидная цепь белковой молекулы, тем большее число различных типов
расщеплений белка приходится использовать.
На завершающей стадии исследования
первичной структуры белка проводится определение положения дисульфидных
мостиков, если таковые имеются. Образование дисульфидных мостиков
происходит при окислении двух остатков цистеина в составе уже сформированных
пептидных цепей. В результате из двух остатков цистеина
образуется остаток диаминодикарбоновой кислоты цистина:
—NH—CH-CO-
|
|
CH2- S
|
|
CH2- S
|
|
—NH-CH-CO-
При этом возникает сшивка либо внутри одной
полипептидной цепи, либо между двумя различными цепями. В качестве примера
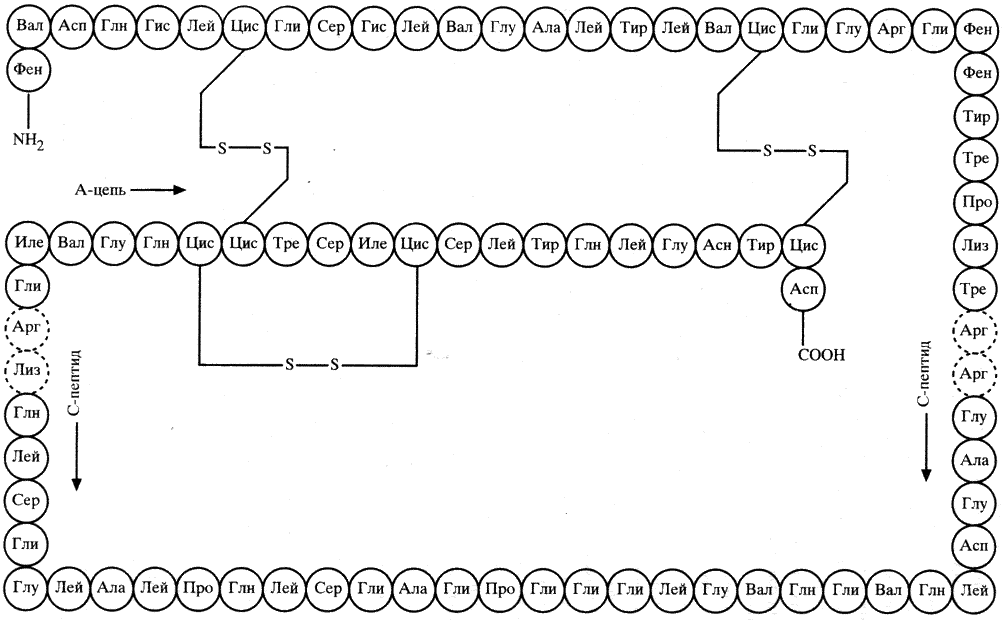
небольшого белка, имеющего две полипептидные цепи (А- и В-цепь), скрепленные
дисульфидными мостиками, а также сшивки внутри отдельных цепей, можно привести молекулу
инсулина (рис. 3) — гормона, вырабатываемого поджелудочной железой и
ответственного за усвоение углеводов, в первую очередь глюкозы. Нарушения в
синтезе инсулина вызывают тяжелое и, к сожалению, весьма распространенное
заболевание—сахарный диабет, при развитых формах которого необходимо ежедневно
вводить в организм этот гормон.
|
|
GIYEQ C CASV C SLYQLENYC N (А-цепь)
|
|
FYNQHLC
GSHLVEALY L V C GERGFFYTPKA (В-цепь)
Рис. 3. Схема строения
молекулы инсулина человека в однобуквенной символике.
Скобкой
обозначен внутрицепочечный, а вертикальными линиями — межцепочечные
дисульфидные связи
Развитие методов анализа последовательности
ДНК сделало возможным на основе генетического кода выводить соответствующие
аминокислотные последовательности, исходя из установленных нуклеотидных. При
реализации такого подхода следует, однако, иметь в виду целый ряд ограничений и
возможные источники ошибок. Во-первых, выведенная из нуклеотидной
аминокислотная последовательность может не соответствовать реальной, вследствие
процессинга, который часто происходит как на уровне информационной РНК, так и
при превращении белка-предшественника в конечный белок. Во-вторых, лишь одна
ошибка в определении последовательности ДНК (пропуск или вставка) приводит к
выведению совершенно неправильной аминокислотной последовательности белка.
Таким образом, установление первичной структуры ДНК не всегда может заменить
непосредственное исследование аминокислотной последовательности кодируемого ею
белка. В то же время параллельное изучение первичных структур белка и ДНК
чрезвычайно эффективно. Установление нуклеотидной последовательности дает
возможность расположить изученные пептидные фрагменты в непрерывную
полипептидную цепь, позволяя решать, таким образом, наиболее сложную задачу
структурного анализа белка. С другой стороны, данные по аминокислотной
последовательности пептидов упрощают и уточняют анализ нуклеотидной
последовательности.
В последние годы анализ первичной
структуры белков на основе исследования нуклеотидной последовательности
соответствующих генов принимает все большие масштабы. Первоначально такие
исследования касались белков прокариотических организмов, в основном E.coli, генетика
которых хорошо изучена, и получение структурных генов не представляло большого
труда. По мере развития методов генетической инженерии появилась возможность
выделять также структурные гены белков эукариот.
Во многих ведущих лабораториях мира
созданы так называемые "банки" или "библиотеки" генов
многих высших животных и человека. В этих банках гены разнообразных белков
хранятся в составе специальных векторов - плазмид или фагов. Для выделения
соответствующего гена из банка используются гибридизационные зонда - небольшие
нуклеотидные фрагменты, синтезированные на основе установленной аминокислотной
последовательности пептидов исследуемого белка. Из-за "вырожденности"
генетического кода могут использоваться не любые последовательности..
Подходящими являются пептиды, содержащие в своем составе аминокислоты,
представленные одним или двумя кодонами, поскольку в этом случае минимально
число различных вариантов олигонуклеотидов, способных кодировать данный пептид.
Оптимальными являются пептиды, содержащие остатки метионина и триптофана,
кодируемые уникальными кодонами. Поэтому особое значение приобретают
исследования по выделению и изучению таких пептидов. Имеются и другие
методические подходы для выделения структурных генов белков, связанные, в
частности, с их способностью в определенных условиях экспрессироваться..
Синтезируемый в результате экспрессии белок может быть идентифицирован,
например, с помощью иммунохимических методов.
Определение аминокислотного состава.
Анализ аминокислотного состава включает полный
кислотный гидролиз исследуемого белка или пептида с помощью 5,7н соляной кислоты и количественное определение
всех аминокислот в гидролизате. Гидролиз образца проводится в запаянных ампулах
в вакууме при 1100 в течение 24 часов. При этом полностью
разрушается триптофан и частично серии, треонин, цистин и цистеин, а глутамин и
аспарагин превращаются в глутаминовую и аспарагиновую кислоты соответственно. В
то же время пептидные связи, образованные аминокислотными остатками с разветвленной
боковой цепью (Val, Ile, Leu), из-за стерических
препятствий гидролизуются частично. Особенно стабильны связи Val-Val, Ile-Ile, Val-Ile, Ile-Val и т.п.
С целью более надежного определения аминокислотного
состава белка проводится параллельный гидролиз в течение 24, 48 и 96 часов, и
все пробы далее количественно анализируются. Для валина, лейцина и изолейцина
берутся максимальные значения, а для серина и треонина полученные значения
экстраполируются к нулевому времени. При анализе содержания в белке триптофана
вместо соляной кислоты для гидролиза используется 4н метансульфоновая кислота
(СН3-SО3). Триптофан можно идентифицировать
спектрофотометрически или с помощью цветных реакций.
Обычно при определении аминокислотного состава белка
ограничиваются анализом суммарного содержания глутамина и глутаминовой кислоты,
аспарагина и аспарагиновой кислоты, а их дифференциация проводится в процессе
установления первичной структуры. Цистеин и цистин анализируются в виде
цистеиновой кислоты или карбоксиметилцистеина.
Количественное определение аминокислот в гидролизате
белка или пептида проводится с помощью аминокислотного анализатора - прибора,
разработанного в 1958 году С.Муром и У.Стенном. Смесь аминокислот разделяется
методом ионообменной хроматографии на колонке, заполненной сульфированной
полистирольной смолой. Колонка промывается буферными растворами с
последовательным повышением их рН и молярности. Время удерживания каждой
аминокислоты строго определенно и зависит от степени ее ионизации.
Постколоночная модификация. Выходящий с колонки элюат смешивается с раствором нингидрина и в специальной ячейке
нагревается до 100°С. Интенсивность образущейся окраски измеряется сначала в
одном калориметре при 570 нм. а затем в другом, где при 440 нм определяется
концентрация пролина и оксипролина. В 1972 г. в качестве селективного
флуорогенного реагента на первичные амины был предложен флуорескамин, а
несколько позже он стал использоваться для модификации аминокислот после их
выхода с колонки аминокнслотного анализатора. Получаемая при этом
чувтвительность определения в 10-100 раз превышает возможности нингидринового
метода. Широкому распространению флуорескамина помешали его нестабильность в
водной среде и высокая стоимость. Этих недостатков лишен введенный в практику почти одновременно с
флуорескамином о-фталевый альдегид (ОФА), но с его помощью нельзя определить
пролин и вторичные амины.
Предколоночная модификация. Реакция фенилизотиоцианата (ФИТЦ) с аминокислотами
изучена детально, поскольку она лежит в основе метода Эдмана (рис.5). Первая
стадия этой реакции - образование фенилтиокарбамильных (ФТК) производных -
используется для количественного определения аминокислот в гидролизате белка в PICO-TAG-анализаторе
(Waters). ФТК-аминокислоты стабильны, легко синтезируются и
успешно идентифицируются методом ВЭЖХ на обращенной фазе. В этих же целях можно
использовать реакции аминокислот с ОФА и дансилхлоридом (рис.4). Однако,
воспроизводимость результатов уступает достигаемой в постколоночном методе.
Определение чистоты препарата белка с помощью
N-концевого анализа
Анализ концевых остатков играет важную роль в процессе
определения аминокислотной последовательности белка. На первом этапе
исследования он дает возможность судить о числе полипептидных цепей,
составляющих молекулу белка, и о чистоте исследуемого препарата. На
последующих этапах с помощью анализа N-концевых аминокислотных остатков
осуществляется контроль за процессом разделения пептидных фрагментов.
Один из первых методов определения N-концевых
аминокислотных остатков был предложен Ф. Сэнгером в 1945 году - динитрофенильный
метод - заключающийся в реакции a-аминогруппы белка или пептида с
2,4-динитрофторбензолом. При этом образуется динитрофенильное производное (ДНФ)
окрашенное в желтый цвет. Последующий кислотный гидролиз 5,7н соляной кислотой
(НСl) приводит к разрыву пептидных связей и образованию
ДНФ-производного N-концевой аминокислоты, которое экстрагируется эфиром и
идентифицируется методом тонкослойной хроматографии в присутствии стандартов.
В настоящее время наибольшее применение
находит метод дансилирования, разработанный в 1962 году В. Греем и Б.
Хартли. Метод основан на введении в a-аминогруппу
белка "флуоресцентной метки", устойчивой в условиях полного
расщепления белка до аминокислот при кислотном гидролизе.
Первая
стадия: 1-диметиламинонафталин-5-сульфохлорид (дансилхлорид, ДНС-С1)
реагирует с непротонированной
a-аминогруппой
пептида (и с боковыми группами цистеина, тирозина, лизина и гистидина) с
образованием дансильного производного пептида (ДНС-пептида). Эта реакция
проводится в щелочной среде в смешанном водно-органическом растворителе
(органический компонент для растворения ДНС-С1). В этих условиях конкурируют два
процесса: дансилирование и гидролиз дансилхлорида до кислоты (ДНС-ОН), а
степень модификации пептида определяется соотношением скоростей протекания этих
процессов (рис.4). Присутствие следовых количеств солей аммония привносимых с
соответствующими буферами приводит к образованию, в процессе реакции,
дансиламида (ДНС-NH2).
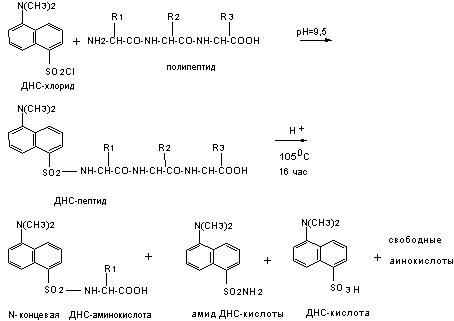
рис.4
Вторая
стадия: кислотный гидролиз модифицированного ДНС-пептида приводит к разрыву
пептидных связей и образованию ДНС-производного N-концевой аминокислоты.
Гидролиз проводится в 5,7н соляной (НС1) кислоте в течение 4-16 час при 1100
С или смесью 5.7 н НСl
и концентрированной трифторуксусной (ТФУ) кислот в соотношении 1:2 - 50мин при
1660 С. Из производных, образующихся по боковым группам после гидролиза
сохраняются e-ДНС-лизин
и о-ДНС-тирозин.
Производные ДНС-аминокислот обладают интенсивной флуоресценцией в ультрафиолетовой области спектра (l 366 нм) и обычно для их идентификации используют как высокоэффективную двумерную тонкослойную хроматографию (ВЭТСХ) на силикагеле или полиамиде, так и ВЭЖХ на колонке с обращенной фазой, при этом достаточно иметь 0,05-0,5 нмоль вещества. В условиях жесткого кислотного гидролиза полностью разрушаются ДНС-триптофан и происходит дезаминирование остатков дикарбоновых кислот, которые превращаются соответственно в ДНС-апарагиновую и ДНС-глутаминовую аминокислоту. Степень разрушения ДНС-пролина, ДНС-серина и ДНС-треонина возрастает по мере увеличения времени гидролиза.
Рис. 5
В то же время связи, образованные остатками валина, лейцина и изолейцина обладают повышенной устойчивостью к гидролизу. Образующиеся при этом дансилдипептиды (ДНС-Ile-Ile, ДНС-Ile-Val, ДНС-Val-Leu и т.п.) на хроматограмме могут быть ошибочно приняты за дансиламинокислоты. Правильность идентификации может быть проверена с помощью более продолжительного гидролиза (24час).
Определение аминокислотной последовательности белков с
помощью метода Эдмана
Основным методом определения аминокислотной
последовательности является метод деградации полипептидной цепи белка с помощью
фенилизотиоцианата (ФИТЦ), разработанный П. Эдманом в 1950-1956г.г.
Метод Эдмана позволяет последовательно отщеплять N-концевые аминокислотные остатки в виде
фенилтиогидантоинов аминокислот (ФТГ).
Каждый цикл деградации включает три стадии: (рис.6)
I стадия - конденсация, образование фенилтиокарбамил пептида (ФТК-пептид);
II стадия - циклизация, отщепление N-концевого
остатка аминокислоты и его циклизация в 2-анилино-5-тиазолинон;
III стадия - изомеризация, 2-анилино-5-тиазолинон N-концевого остатка аминокислоты изомеризуется в
фенилтиогидантоин, который в дальнейшем идентифицируется.
Первая стадия. На первой стадии реакции
происходит присоединение фенилизотиоцианата (ФИТЦ) к a-аминогруппе пептида с образованием
фенилтиокарбамильного производного пептида (ФТК-пептида). Реакция проводится в
летучих буферных системах при рН 9,0-9,5, в качестве оснований используются тритичные
и ароматические амины (триэтиламин,
триметиламин, N-метилпипиридин, пиридин). Выход
на этой стадии может существенно снижаться вследствие побочных реакций. Такими
реакциями являются окислительное десульфирование ФТК-группы пептида под
действием кислорода воздуха, блокирование a-аминогруппы пептида за счет образования оснований
Шиффа со следовыми количествами альдегидов, присутствующих в реагентах и
растворителях. Поэтому все стадии деградации пептидов проводятся в атмосфере
инертного газа, а используемые реагенты предварительно тщательно очищаются. В
щелочных условиях ФИТЦ гидролизуется с образованием моно- и дифенилтиомочевины
и анилина. Избыток реагентов и побочных
продуктов
удаляется экстракцией органическими растворителями (этилацетатом и
хлорбунаном).
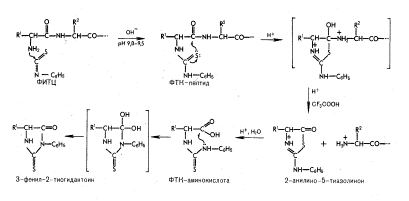
Рис. 6
Вторая стадия. На второй стадии деградации
в присутствии безводной сильной трифторуксусной кислоты отщепляется N-концевой
остаток в виде 2-анилино-5-тиазолинона и образуется укороченный на одну
аминокислоту пептид со свободной a-аминогруппой следующего остатка. Условия реакции
обычно не вызывают неспецифического расщепления полипептидной цепи белка.
Однако остаток глутамина, когда он становится N-концевым в пептиде, может
превращаться в остаток пироглутаминовой кислоты, блокирующий дальнейшую
деградацию. В случае последовательности Asn-Gly возможна
перегруппировка, при которой образуется циклический имид ангидрида
аспартилглицила (рис.6). Возможна также 0—N-ацильная миграция у остатков
ацилсерина и ацилтреонина, которая приводит к блокированию процесса
расщепления.
Третья стадия. Изомеризация - состоит из быстрого гидролиза тиазолинона в
производное фенилтиокарбамил аминокислоты (ФТК-аминокислота), а затем
циклизация последнего в фенилтиогидантоин N-концевого остатка аминокислоты (ФТГ-аминокислота).
Способ обнаружения ФТГ-производных аминокислот основан на их сильной абсорбции в УФ-области
спектра с максимумом поглащения 265-270 нм (среднее значение молярного
коэффициента экстинкции равно 16000).
Повторное, цикл за циклом, проведение реакции Эдмана с
одновременной идентификацией ФТГ-производного отщепляемой аминокислоты
(«прямой» Эдман) позволяет
устанавливать аминокислотную последовательность исходного белка или
пептида.
В 1972 г. В.Греем было предложено использовать метод
Эдмана в сочетании с реакцией дансилирования (ДНС-Эдман). С этой целью после
каждого цикла отщепления по Эдману отбирается небольшая проба образца
(аликвота) и анализируется N-концевой остаток укороченного пептида с помощью
реакции дансилирования. Этот подход выгодно отличается от «прямого» Эдмана, так
как при этом отсутствует стадия промывки (экстракции), удаляющая избыток
реагентов и побочных продуктов, образовавшихся в процессе реакции конденсации,
что позволяет исключить возможные потери пептидов (особенно неполярных) за счет
их растворения в органическом расворителе. Постепенное уменьшение количества
анализируемого материала (в результате отбора аликвот) компенсируется более
высокой чувствительностью определения флуоресцирующих производных аминокислот.
Определения С-концевой последовательности белков
с помощью карбоксипептидаз
Ферментативный метод основан на
использовании карбоксипептидаз (экзопептидазы класса гидролаз), которые атакуют
в молекуле белка связи, расположенные по соседству со свободными a-карбоксильными группами, и отщепляют последовательно
по одному остатку аминокислоты с С-конца полипептидной цепи. Изучая кинетику
отщепления аминокислот карбоксипептидазами, можно получить информацию о
последовательности расположения их на С-концевом участке молекулы белка или
пептида. При исследовании структуры белков используется несколько типов
карбоксипептидаз (А, В, С, Р, Y), которые
различаются по скорости отщепления индивидуальных аминокислот. Карбоксипептидаза
А (из поджелудочной железы крупного рогатого скота) отщепляет с наибольшей
скоростью аминокислоты с ароматической и длинной алифатической боковой цепью: Phe, Tyr, Trp, Leu, Ile, Met,Val. С меньшими скоростями отщепляются Thr, Gln, His, Ala,
HSer, Asn, Ser, Lys. Очень медленно
высвобождаются Gly, Glu, Asp, Cys-SO3H, KM-Cys и совсем не гидролизуются связи образованные
С-концевыми Pro и Arg. Карбоксипептидаза В (из поджелудочной железы
свиньи) быстрее всех других отщепляет основные аминокислоты - лизин,
аргинин, орнитин и не отщепляет С-концевой Pro. Пептидная связь, образованная остатком аргинина,
гидролизуется быстрее, чем связь, образованная остатком лизина. Оптимальным
значением рН для карбоксипептидаз А и В являются рН 7,5-8,5. Оно меняется в
зависимости от субстрата. Так при снижении рН до 5,0 возрастает скорость
отщепления С-концевых дикарбоновых аминокислот, тогда как при рН более 9,0
возрастает скорость отщепления лизина и гистидина. Карбоксипептидаза С (выделена из ряда растительных
источников, включая цитрусовые) Этот
фермент соединяет в себе специфичность карбоксипептидаз А и В и в то же время
может отщеплять С-концевой Pro. Скорости
высвобождения приблизительно одинаковы для всех аминокислот, за исключением
Gly, который выщепляется очень медленно. Карбоксипептидаза
Р (получена из Aspergillus и Penicillum) Она активна при рН 2,5 и имеет специфичность,
сходную с таковой для карбоксипептидазы С. Карбоксипептидаза Y (из
пекарских дрожжей) отщепляет, практически все аминокислоты, включая Pro. Гидролиз проходит наиболее эффективно при рН 5,5
- 6,5. Оптимальное значение рН для отцепления лизина и
аргинина = 7,0.
При работе с карбоксипептидазами следует учитывать
следующие основные проблемы: 1) многие препараты панкреатических ферментов А и
В содержат эндонуклеазы (трипсин, химотрипсин), которые следует инактивировать
добавлением диизопропилфторфосфата(DIPF); 2)
следует учитывать различие в скоростях отщепления отдельных аминокислот, зависящее
как от природы боковой цепи у отщепляемого остатка, так и от природы
аминокислоты расположенной в соседнем положении. Отщепление С-концевой
аминокислоты значительно ускоряется, если перед ней находится остаток с
ароматической или алифатической боковой цепью. Напротив, если в соседнем
положении находится глицин, пролин, глутаминовая кислота, то скорость гидролиза
снижается; 3) возникают осложнения и в случае, когда в С-концевой
последовательности стоят подряд несколько остатков одной и той же аминокислоты.
Поэтому при использовании карбоксипептидаз, надежно, удается вывести
последовательность не более чем трех-пяти аминокислотных остатков, расположенных
в белке в С-концевом положении.
Количество анализируемого материала зависит от чувствительности используемого метода идентификации. Освобождающиеся аминокислоты определяют или методом дансилирования с последующей ВЭТСХ, или количественно на аминокислотном анализаторе. Результаты представляют в виде графика зависимости количества отщепившейся аминокислоты (моль/моль белка) от времени (рис.7). Скорость появления освобождающихся аминокислот во времени позволяет сделать вывод о С-концевой последовательности белка.
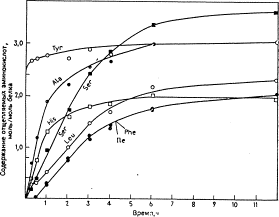
(рис. 7) Отщепление аминокислот альдолазы
мышцы кролика карбоксипсптидазой А
|
Ser-Leu-Phe-Ile-Ser-Asn-His-Ala-Tyr-OH |
|
9 8
7 6 5
4 3 2
1 |
Перед проведением количесвенного анализа следует
убедиться, что отщепление действительно происходит, подобрать оптимальное
соотношение фермента и субстрата, подобрать продолжительность расщепления. Для
белков обычно необходимы предварительная денатурация и перевод в растворенное
состояние. Для плохо растворимых белков расщепление можно проводить в 6М
мочевине или в 0,05М додецилсульфате натрия (SDS). В обычном эксперименте образец белка инкубируют с
карбоксипептидазами в подходящем буферном растворе (0,2М
N-этилморфолинацетатном, 0,1М Na-бикарбонатном,
аммоний-бикарбонатном, 0,05М пиридин-ацетатном и т.п.). Если в ходе
предварительного эксперимента обнаруживается высвобождение многих аминокислот,
то следует использовать соотношение фермент:субстрат 1:100 или 1:200 (по весу)
и/или проводить отщепление при комнатной температуре. Если аминокислоты
высвобождаются медленно, то следует увеличить соотношение фермент:субстрат 1:20
или 1:10 (по весу) и температуру до 370 С.
Приложение
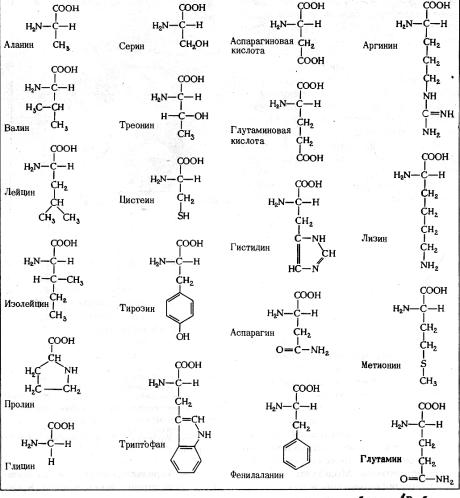
Структура a-аминокислот, наиболее часто встречающихся в белках
|
Наименование аминокислоты |
Обозначение аминокислоты |
Молекулярная масса |
Молекулярная
масса без H2O |
|
|
|
трехбукв. код |
однобукв. код |
|
|
|
Аспарагиновая
кислота |
Asp |
D |
133 |
115 |
|
Глутаминовая кислота |
Glu |
E |
147 |
129 |
|
Аланин |
Ala |
A |
89 |
71 |
|
Цистеин |
Cys |
C |
121 |
103 |
|
Глицин |
Gly |
G |
75 |
57 |
|
Изолейцин |
Ile |
I |
131 |
113 |
|
Лейцин |
Leu |
L |
131 |
113 |
|
Метионин |
Met |
M |
149 |
131 |
|
Фенилаланин |
Phe |
F |
165 |
147 |
|
Серин |
Ser |
S |
105 |
87 |
|
Треонин |
Thr |
T |
119 |
101 |
|
Тирозин |
Tyr |
Y |
181 |
163 |
|
Валин |
Val |
V |
117 |
99 |
|
Аргинин |
Arg |
R |
174 |
156 |
|
Гистидин |
His |
H |
154 |
136 |
|
Лизин |
Lys |
K |
146 |
128 |
|
Пролин |
Pro |
P |
115 |
97 |
|
Аспарагин |
Asn |
N |
132 |
114 |
|
Глутамин |
Gln |
Q |
146 |
128 |
|
Триптофан |
Trp |
W |
204 |
186 |