О защите российского приоритета
в синтезе трансурановых химических элементовАртем Буслаев
1
IUPAC – International Union of Pure and Applied Chemistry (Международный союз чистой и прикладной химии) – международная организация, устанавливающая названия для химических соединений.2
IUPAР – International Union of Pure and Applied Physics (Международный союз чистой и прикладной физики).3
ICD (Inorganic Chemistry Department) – отдел неорганической химии IUPAС.Современная ядерная энергетика не лишена недостатков
(опасность аварии, необходимость решать проблему радиоактивных отходов и пр.). Однако многие из этих проблем отпадут, если удастся синтезировать долгоживущие изотопы элементов так называемого “острова относительной стабильности”, то есть если добываемый уран будет не сразу “сжигаться” в реакторах, а на ускорителях будет перерабатываться в элементы типа 114-го (теория предсказывает, что его изотоп с атомной массой 298 может иметь время жизни, сравнимое с ураном и торием). При делении одного такого атома может выделяться до 10 нейтронов, а не 2-3, как в уране, а “критическая масса” такого вещества может составлять миллиграммы, что снижает опасность аварии и позволяет создать более компактные реакторы. И проблема отходов решается: если сейчас считается, что в ОЯТ наиболее опасны трансурановые изотопы, то в гипотетических реакторах на 114-м элементе эта опасность исчезнет: изотопы, более тяжелые, чем исходное топливо, будут распадаться практически мгновенно, а образующиеся при делении ядер изотопы элементов середины таблицы Менделеева будут распадаться быстрее, чем после урановых реакторов, поскольку эти изотопы будут более высоконейтронными, и как следствие, будут иметь более короткое время жизни. Понятно, что пройдет еще немалое время, прежде чем подобная технология станет промышленной, но шаги к этому уже сделаны.Продвижением в область “острова стабильности” занимаются три лаборатории: Беркли в США, Дармштадт в Германии и Дубна в России. С начала 1960-х годов и по сей день Дубна уверенно лидирует в этой области, однако после развала СССР в 1991 г
. наблюдается открытое попрание авторитета дубненских ученых: согласно общепринятым научным правилам, названия вновь открытым химическим элементам даются по предложениям их первооткрывателей. В равной степени это относится и к искусственно синтезированным трансурановым элементам.Так, элементы с атомным номером от 93 (нептуний) до 101 (менделевий) были впервые синтезированы американскими учеными и
, естественно, ими были предложены их названия. В 1957 г. сотрудники Нобелевского института (Стокгольм) поспешили объявить об открытии элемента номер 102, которому они предложили дать название “нобелий” (No). Однако эксперименты, проведенные в СССР и США, не подтвердили это открытие. Впервые изотопы 251-256 элемента 102 были получены в СССР в 1963-1967 гг. группой Г. Н. Флёрова, которая предложила назвать этот элемент “жолиотий” (Jl) в честь известного физика Жолио-Кюри.В 1961 г
. группа Гиорсо из Беркли поспешила объявить об открытии элемента номер 103, который они предложили назвать “лоуренсием” (Lr). Однако американцы не смогли даже сказать, какой изотоп они получили – 257 или 258, не говоря уже об идентификации его свойств. Синтез элемента номер 103 и установление его свойств было произведено сотрудниками Г. Н. Флёрова в Дубне в 1965-1967 гг. В конечном итоге американцы в журнале “The Physical Review” (август 1971 г.) были вынуждены признать, что “элемент номер 103 впервые был синтезирован в Дубне”. Советские первооткрыватели предложили назвать этот элемент резерфордием (Rf) в честь создателя ядерной модели атома Э. Резерфорда.Приоритет советских ученых в открытии элементов 104 и 105 никем всерьез не оспаривался, поэтому эти элементы вошли в таблицу Менделеева под названиями
, соответственно, “курчатовий” (Ku) и “нильсборий” (Ns). В свою очередь названия “нобелий” и “лоуренсий” для элементов номер 102 и 103 в таблице Менделеева фигурировали в скобках, ибо приоритет их открытия до сих пор оспаривается.Однако в течение последних нескольких лет в публикуемых вариантах таблицы Менделеева элементы с номерами
102-105 фигурируют не под теми названиями, которые дали им их первооткрыватели, а как 102No, 103Lr, 104Rf, 105Db, причем сообщается, что эти названия утверждены IUPAC1. Налицо подмена научного приоритета российских ученых в открытии элементов 102 и 103, попрание достижений российских ученых в открытии элемента 104 (отказ от его названия в честь нашего соотечественника), а в качестве утешительного приза элементу 105 дано название в честь места его открытия, но опять же не соответствующее тому, которое дали его первооткрыватели.Давайте посмотрим, есть ли для этого какие-то основания. А для начала приведем выдержки из первоисточника – статьи Г.
Н. Флёрова “Устойчивость тяжелых ядер и граница периодической системы элементов” (УФН. 1970. Т. 100, вып. 1)1. Элемент 102
Впервые надежная информация о свойствах пяти изотопов 102-ro элемента была получена в Дубне в экспериментах, завершенных в 1966 г. В 1967 г. результаты дубненских опытов были воспроизведены и подтверждены в Радиационной лаборатории им. Лоуренса в Беркли.
В связи с тем, что после 1
966—1967 гг. появилось несколько статей, авторы которых, излагая историю 102-го элемента, допускают ее произвольное, недостаточно объективное толкование, хотелось бы более подробно рассмотреть исторический аспект этой проблемы.Прежде всего остановимся на двух аналогичным работах, в которых были получены совершенно различные результаты. Первая из них выполнена в Нобелевском институте физики в
Стокгольме в 1957 г. совместно американскими, английскими и шведским физиками, а вторая - в Радиационной лаборатории им. Лоуренса в Беркли в 1958 г. В этих работах была предпринята попытка идентифицировать 102-й элемент, используя метод разделения, основанный на ионообменной хроматографии. Мишени из смеси изотопов кюрия (244Cm — 95%, 245Cm — 4%) облучались пучком ионов 13С. Получавшиеся в ядерных реакциях продукты выбивались из мишени и собирались на сборниках, которые после получасового облучения подвергались химической обработке. Выделенные продукты анализировались в ионизационной камере с целью обнаружения α-активности, связанной с распадом 102-го элемента.Этим методом была обнаружена
α-активность с энергией 8,5±0,1 МэВ и периодом полураспада около 10 мин. Всего было зарегистрировано около 20 событий. Делалось предположение, что это либо изотоп 253102, либо 251102, которые могли получаться в реакциях 244Cm (13С, 4n) 253102 и 244Cm (13C, 6n) 251102.После пуска линейного ускорителя тяжелых ионов в Беркли в 1953 г. Гиорсо и др.
попытались повторить стокгольмские результаты, пользуясь аналогичной методикой. Однако поиски α-активности, о которой сообщалось в первой работе, оказались безуспешными. Ни в одном из опытов, которые велись в течение нескольких месяцев, α-активность с Eα=8,5 МэВ и Т1/2=10 мин не была обнаружена. Результаты опытов, проведенных в Беркли, поставили под сомнение тот факт, что в Стокгольме был получен 102-й элемент. Гиорсо и др. предположили, что α-активность, наблюдавшаяся в стокгольмской работе, могла относиться к легким элементам и была ошибочно приписана 102-му элементу.Отрицательный результат, полученный в
Беркли, естественно, вызвал ответную реакцию авторов первой работы. В 1959 г. они опубликовали статью, в которой отсутствовали какие-либо новые экспериментальные данные, а старым дана несколько иная интерпретация.Новая интерпретация сводилась к тому, что делалось предположение
о принадлежности наблюдавшейся α-активности не 253102 или 251102, а 255102, который мог получиться в реакции 246Cm (13С, 4n) 255102. Забегая несколько вперед, отметим, что измерение периода полураспада изотопа 255102, синтезированного в Дубне в 1966 г., дало значение Т1/2=3 мин; кроме того, энергия α-частиц оказалась равной 8,09, а не 8,5 МэВ. Неудачные попытки идентифицировать 102-й элемент традиционными химическими методами из-за малого времени жизни его изотопов привели исследователей к разработке физических методов идентификации.Один из них был впервые использован в опытах по получению 102-го элемента в Институте атомной энергии в Москве в 1957—1958 гг.
В московских опытах мишени из изотопов плутония 241Рu и 239Рu облучались ускоренными до энергии 100 МэВ ионами кислорода 16О. Атомы отдачи вбивались в алюминиевый сборник, который в течение 1,5—2 с перемещался из зоны облучения на расстояние 2 м, где располагались ядерные фотоэмульсии, служившие детекторами α-частиц. Активация сборника и его нагрев пучком ионов за счет больших удельных потерь на ионизацию существенным образом влияли на качество работы ядерных фотоэмульсий, ухудшая их разрешающую способность.Основная трудность, с которой пришлось столкнуться экспериментаторам, была связана с возникновением
α-радиоактивного фона на примесях свинца и более легких элементов в материалах мишени и сборника. При взаимодействии кислорода со свинцом образуется целая гамма α-активных изотопов в области полония и выше за счет различных реакций. Так в Москве впервые были обнаружены группы α-частиц с энергией 11,65 и 8,87 МэВ, которые обусловлены, как выяснилось несколько позже, распадом изомеров полония 211mPo и 212mPo. Точность измерения энергии α-частиц с помощью ядерных фотоэмульсий не позволяла разрешить ряд других α-групп, о существовании которых теперь хорошо известно. Вопросам фона в московских опытах было уделено очень большое внимание. Для этого были разработаны высокочувствительный активационный метод анализа мишеней и сборников на содержание свинца, а также методы очистки материала мишени от посторонних примесей. Результаты этой работы явились базой для многих последующих экспериментов, проведенных в Дубне.В работе 1958 г. использовались две плутониевые мишени: первая содержала 180 мкг/см
2 241Рu, а вторая - 100 мкг/см2 241Рu. С первой мишенью была проделана серия опытов (40 облучений по три часа каждое), в которых время экспозиции под пучком и около фотопластинки составляло 8 с, а время движения сборника 3 с. В результате этих опытов наблюдались α-частицы с энергией в интервале 8,2—9,0 МэВ, а всего их было зарегистрировано 90. Тщательный активационный анализ показал, что примеси свинца могут обусловить не более 40% всего числа наблюденных α-частиц в этом интервале энергий. Вторая мишень была изготовлена после дополнительной очистки плутония и содержала значительно меньше свинца, чем первая. В результате десяти трехчасовых облучений в том же режиме работы регистрирующего устройства наблюдалось 20 α-частиц в интервале энергий 8,2—9,0 МэВ. Активационный анализ показал, что только четыре из них можно отнести за счет загрязнений мишени свинцом.Как уже отмечалось, метод определения энергии
α-частиц с помощью фотоэмульсии не обладает высокой точностью.Из сопоставления спектров
α-частиц, измеренных с помощью полупроводниковых детекторов и фотоэмульсий при облучении Pb ионами 16О, видно, что многие α-группы не были разрешены в фотоэмульсиях и что энергия основных групп α-частиц несколько завышена. С учетом поправок в энергиях α-частиц α-группа, отнесенная к распаду 102-го элемента, имеет энергию 8,6±0,4 МэВ. Оценки периода полураспада этого изотопа давали значение в интервале 2 с<T1/2<40 с. Авторам не удалось детально изучить функцию возбуждения реакции, приводящей к образованию нового излучателя. Однако при тех значениях энергии ионов 16О, которые использовались в опытах по облучению 241Рu, могли иметь место только два вида испарительных реакций с вылетом либо четырех, либо пяти нейтронов.В настоящее время мы знаем (об этом
- ниже), что изотоп 252102 обладает свойствами, близкими к тем, что наблюдались в московской работе. Очевидно, именно этот изотоп наблюдался в опытах 1957—1958 гг. в ядерной реакции 241Pu (16O, 5n)252102.Убедительность результатов, полученных Гиорсо и др., в течение шести лет не вызывала сомнений вплоть до тех пор, пока в Дубне в 1964 г. не были начаты опыты с целью проверки результатов берклиевской группы, причем проводились они двумя методами, в которых регистрировался дочерний
250Fm и первичные α-частицы. К удивлению, было обнаружено значительное расхождение с данными Гиорсо и др. о свойствах 254102. Оказалось, что период его полураспада равен 60 с, а не 3 с, энергия α-частиц составляет 8,11, а не 8,3 МэВ.После этого в Дубне на протяжении 1964—1967 гг. были проведены
систематические исследования свойств нескольких изотопов 102-го элемента. Работа велась по трем направлениям:1) изучение
α-распада изотопов с массовыми числами 251—256;2) изучение спонтанного деления четно-четных изотопов
256102 и 254102;3) изучение химических свойств элемента 102 с использованием экспрессного метода газовой химии.
Для исследования
α-распада использовались два метода: в одном изотопы 102-го элемента детектировались по соответствующим дочерним изотопам фермия, как описывалось выше, в другом изучалось α-излучение ядер-продуктов реакции с помощью полупроводниковых детекторов α-частиц с хорошим энергетическим разрешением; в этом случае вынос продуктов реакции из зоны облучения осуществлялся газовой струей с последующим механическим перемещением сборника к (Si+Au)-детектору. Было изготовлено два варианта аппаратуры: для внешнего пучка ионов и для отклоненного внутреннего пучка 310-cм циклотрона (рис. 1).В опытах, где регистрировались
α-частицы 102-го элемента, использовались мишени из различных изотопов урана, плутония и америция, подвергавшиеся тщательной очистке от примесей Bi, Pb и других элементов. Хорошее разрешение поверхностно-барьерных кремниевых детекторов и высокая стабильность электронной аппаратуры позволяли надежно выделять в α-спектрах линии, обусловленные α-распадом изотопов 102-го элемента даже при наличии некоторого фона за счет незначительных примесей свинца в материале мишени. Таким образом, удалось установить энергии α-распада и времена жизни для шести изотопов, которые оказались существенно отличными от всех ранее опубликованных данных. С другой стороны, следует отметить, что в Дубне наблюдалось хорошее согласие между результатами, полученными с помощью разных методик.После того как в октябре 1966 г. стали известны результаты опытов по определению радиоактивных характеристик изотопов
252-256102, выполненных в Дубне, берклиевская группа провела контрольные эксперименты и целиком подтвердила данные о свойствах всех пяти изотопов. Дополнительно в Беркли были синтезированы изотопы 251102 и 257102. Аналогичные данные о 251102 независимо получены в 1957 г. и в Дубне.В табл
. 1 просуммированы данные о свойствах известных изотопов 102-го элемента. Для сравнения указаны результаты обеих групп.Таблица 1
Данные о свойствах известных изотопов 102-го элемента
|
Массовые числа изотопов |
Дубна, 1965-1967 гг. |
Беркли, 1966-1967 гг. |
||
|
Т 1/2, с |
Е α, МэВ |
Т 1/2, с |
Е α, МэВ |
|
|
251 |
0,5–1,0 |
8,6 |
0,8±0,3 |
8,68 (20%) |
|
8,6 (80%) |
||||
|
252 |
4,5±1,5 |
8,41 |
2,3±0,3 |
8,41 (70%) |
|
(30%) |
||||
|
253 |
95±10 |
8,01 |
105±20 |
8,01 |
|
254 |
50±10 |
8,11 |
55±5 |
8,10 |
|
75±15 |
||||
|
255 |
180±10 |
8,08 |
185±20 |
8,11 |
|
256 |
6±2 |
8,41 |
3,2±0,2 |
8,43 |
|
9±3 |
||||
|
3,7±0,5 |
||||
|
257 |
- |
- |
23±2 |
8,27 (50%) |
|
8,23 (50%) |
||||
Таким образом, результаты дубненских экспериментов показали, что в ранних работах по 102-му элементу по разным причинам допущены существенные ошибки. Из табл
. 1 видно, что ни один из изотопов с массовыми числами 251—256 не обладает теми свойствами, которые приписывались им авторами первых работ. Так, свойства нечетных изотопов с массовыми числами 251, 253 и 255 ничего общего не имеют с 10-мин активностью (Еα=-8,5 МэВ), наблюдавшейся в стокгольмских опытах 1957 г., авторы которых предложили назвать элемент 102 нобелием. Не подтверждены и американские данные 1961 г. о 255l02 (Т1/2=15 с, Еα=8,2 МэВ) и 1958 г. о 254l02 (Т1/2» 3 с. Е α=8,3 МэВ).По существу, только в
1970 г. внесена полная ясность в запутанную десятилетнюю историю элемента 102-го элемента.2. Элемент 103
Не менее драматичной представляется история 103-го элемента. Группа американских ученых в Беркли в течение 1958—1961 гг. делала неоднократные попытки синтезировать 103-й элемент. В 1958 г. мишень из
244Cm и 242Cm облучалась ионами азота 14N. Атомы отдачи, заторможенные в газе, собирались электрическим полем, и α-частицы от распада продуктов реакций детектировались с помощью ядерных фотоэмульсий. В экспериментах наблюдалась слабая α-активность с энергией 9±1 МэВ и T1/2=0,25 с, которая весьма предположительно была приписана изотопу 103. О дальнейших экспериментах, направленных на уточнение этих данных, авторы ничего не сообщали.В 1960 г. Гиорсо сообщил о попытках синтеза изотопов 103-го элемента с массовыми числами 259 и 260. В этой серии экспериментов мишень из калифорния облучалась ускоренными ионами
11В. Регистрация и идентификация 259103 осуществлялась генетическим методом по фермию-255, образующемуся по цепочке: 259103® 255Md® 255Fm.Однако экспериментальная методика была несовершенна, а уровень фона слишком высок. Авторы, наблюдая
255Fm на вторичном сборнике в продуктах α-распада, не смогли сделать вывод о свойствах 259103. Эксперименты также не дали определенных результатов и для 260103 по тем же причинам.И, наконец, в 1961 г. была опубликована работа, в которой сообщалось о синтезе и идентификации
257103 при облучении калифорниевой мишени (249<А<252) ионами 10В и 11B. В спектре α-частиц, испускаемых продуктами ядерных реакций, была обнаружена групп α-частиц с Еα=8,6 МэВ, отнесенная к распаду изотопа 257103 с Т1/2=8 с.Основанием для такого вывода послужили следующие факты:
-
отсутствие этой активности в продуктах облучения мишеней из РЬ, Bi, 240Pu и 241Am ионами 10В и 11В и мишени из 243Am ионами 12C;- уменьшение выхода той же активности (Т1/2=8 с, Еα=8,6 МэВ) вдвое при замене бора на 12С;
- устойчивый выход активности в течение нескольких месяцев работы.
Функция возбуждения имела вид очень широкой кривой как с 10В, так и с 11В из-за сложного изотопного состава мишени. Таким образом, по виду функций возбуждения нельзя было сказать, представляют ли они наложение нескольких реакций с испарением нейтронов, приводящих к изотопу 103-го элемента, или же они являются функциями возбуждения каких-либо других реакций.
Эти эксперименты с 1961 г. не повторялись и никаких новых публикаций о данных 1961 г. не было. Появились лишь сообщения, что авторы пересмотрели свои экспериментальные результаты и считают, что, по-видимому, изотоп 103-го элемента, испускающий α-частицы с энергией 8,6 МэВ и Т1/2=8 с, имеет массу не 257, а 258 или 259.
Таким образом, новая интерпретация старых данных 1961 г. сводится к тому, что один из трех изотопов с массовыми числами 257, 258 или 259 распадается путем испускания α-частиц с Т1/2=8 с и Еα=8,6 МэВ. Столь неопределенная идентификация массового числа (а дальше будет видно, что даже она представляется весьма сомнительной) мало что дает для систематики α-распада и для физической идентификации самого 103-го элемента.
Вместе с тем в 1965 г. в Дубне был синтезирован другой изотоп 256103. В 1967 г. там же проводилось более тщательное изучение ядерно-физических свойств этого изотопа, исследовалось химическое поведение его хлоридов. Попытки воспроизвести в Дубне данные по 257103, полученные берклиевской группой в 1961 г., не дали положительного результата. Поэтому целесообразно провести сопоставление и анализ результатов, полученных в различных работах по синтезу 103-го элемента, с целью установления степени их достоверности.
Наиболее тщательно изучен изотоп 103-го элемента с массовым числом 256. Данные дубненской группы были подтверждены в Беркли, где этот изотоп был использован для изучения химических свойств (экстракции) 103-го элемента.
В работе 1965 г. изотоп 256103 был синтезирован при облучении мишени из 243Am ионами 18О на внутреннем пучке 310-см циклотрона Объединенного института ядерных исследований (ОИЯИ). Регистрация и идентификация изотопа 256103 проводилась генетическим методом по изотопу 252Fm — продукту его радиоактивного распада. Методика “двойной отдачи” позволяла обнаружить в продуктах распада фермий независимо от типа распада материнского изотопа:
256
103® 252Md® 252Fm; 256103® 256102® 252Fm.
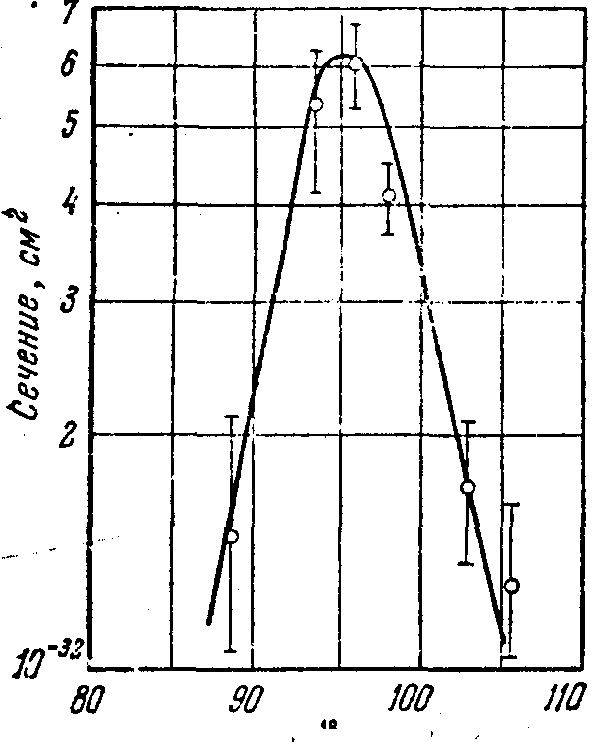
Рис.
1. Кривая зависимости выхода 252Fm в продуктах распада от энергии ионов 18ОФермий как продукт радиоактивного распада выделялся химически с помощью ионообменных методов и идентифицировался по Еα и Т1/2. Было показано, что на вторичном сборнике действительно накапливается 252Fm (Еα=7,04 МэВ, Т1/2=25 ч). Кривая зависимости выхода изотопа 252Fm в продуктах распада от энергии ионов 18О представлена на рис. 1. Она имеет типично “испарительный” вид с шириной на полувысоте около 9 МэВ и максимумом при 96 МэВ. Это является дополнительным убедительным доказательством того, что 252Fm появляется как продукт распада 256103, образующегося в результате реакции “испарения” пяти нейтронов 243Am (18О, 5n) 256103. Измерения периода полураспада 256103 дали результат 45±10 с. Таким образом, с высокой степенью надежности был установлен факт синтеза изотопа 103-го элемента и его массовое число.
В 1967 г. эксперименты по исследованию свойств изотопов 103-го элемента были продолжены. В опытах, выполненных двумя группами на разной аппаратуре, регистрировались непосредственно α-частицы от изотопов 103-го элемента. Использовался метод сбора атомов отдачи из газовой струи и регистрация α-частиц с помощью кремниевых детекторов. Моноизотопная мишень 243Am, как и прежде, облучалась ионами 18О, что позволяло проводить идентификацию продуктов реакций с испарением нейтронов по функциям возбуждения. Большое внимание было уделено очистке мишеней от примесей свинца, чтобы исключить α-радиоактивный фон.
Группы α-частиц с энергиями в диапазоне 8,35—8,6 МэВ связаны с распадом изотопов 103-го элемента с массовыми числами 256 и 257. Из рис. 1 видно, что α-спектр сложный, имеется несколько групп α-частиц. Если интересоваться группой 8,6 МэВ, отнесенной к 257103, то можно условно разделить весь спектр на две части: 8,35<Еα<8,5 МэВ и 8,5<Еα<8,6 МэВ и проследить поведение каждого из этих участков. Оказалось, что временное распределение импульсов, т. е. периоды полураспада для обеих частей практически равны и составляют 35 с.
Кривые выхода α-излучателей для обеих частей спектра, т. е. положение максимумов и форма кривых, хорошо согласуются как с расчетными значениями для реакции 243Am (18О, 5n) 256103, так и с экспериментальными данными для этой реакции, полученными в 1965 г. Все это послужило основанием отнести группу α-частиц с 8,35<Еα<8,50 МэВ к распаду изотопа 256103.
Много усилий в рассматриваемой работе было затрачено на поиски
α-активности с Еα=8,6 МэВ и T1/2=8±2 с, отнесенной берклиевской группой 1961 г. к изотопу 257103. Эксперименты проводились при энергии ионов 18О от 90 до 96 МэВ, т. е. в области, где должен находиться максимум сечения реакции 243Am (18О, 4n) 257103. Группа α-частиц с Еα=8,6 МэВ и T1/2=8 с не наблюдалась. Верхняя граница сечения образования этой активности при энергии 18О, равной 91 MэВ, составила 2•10-33 см2, что сильно отличается в меньшую сторону от ожидаемой величины на основе суммы всех экспериментальных данных по сечениям (HI, xn)-реакций. С α-распадом изотопа 257103 можно было связать лишь группу с 8,5<Еα<8,6 MэВ и Т1/2=35 с. Итак, результатом дубненских экспериментов 1965—1967 гг. явилось однозначное доказательство синтеза изотопа 256103. В то же время попытки воспроизвести данные Беркли о 257103 не дали положительного результата.Остановимся несколько подробнее на новой интерпретации результатов 1961 г. Нам представляется, что она противоречит экспериментальным данным оригинальной работы
(α-спектрам и виду функции возбуждения), на основании которых было объявлено об открытии 103-го элемента и предложено его название.Приведем реакции, с помощью которых возможно образование изотопов элемента 103.
Максимальный выход имеют ядерные реакции, вызываемые тяжелыми ионами, сопровождающиеся испарением четырех и пяти нейтронов. Соответствующие ширины кривых составляют 8—10 МэВ. Так как функции возбуждения для активности с Еα=8,6 МэВ в эксперименте были очень широкими, первоначальная интерпретация этого факта представляется наиболее естественной.Изотоп
259103 при облучении калифорния ионами 10В должен был получаться практически только в реакции 252Cf (10B, 3n): функция возбуждения должна быть узкой (полуширина 10 МэВ}. Однако этого не наблюдалось. Аналогичные соображения можно привести относительно изотопа 258103. С помощью ионов 10В он может получаться в реакциях 252Cf (10B, 4n), 251Cf (10B, 3n). Учитывая, что сечение (3n)-реакции меньше сечения (4n)-реакции и что содержание в мишени 251Cf в четыре раза меньше, чем 252Cf, можно ожидать, что кривая выхода 258103 должна иметь вид, совпадающий с кривой выхода в реакции 252Cf (10B, 4n), т. е. должна быть достаточно узкой.Кроме того, за счет реакций с испарением четырех-пяти нейтронов на изотопе
250Cf должен был образоваться изотоп 256103 и его α-частицы должны присутствовать в n-спектре. Однако из приведенного в американской работе спектра этого не видно.Ввиду этого противоречия требуются дополнительные экспериментальные доказательства того, что в 1961 г. в Беркли действительно был синтезирован изотоп 103-го элемента.
3. Элемент 104 (курчатовий
)Синтез 104-го элемента был осуществлен в Дубне в 1964—1967 гг.
Поскольку ожидалось, что время жизни четно-четных изотопов 104-го элемента, которые можно синтезировать в ядерных реакциях с многозарядными ионами, мало, а определяющим процессом распада будет спонтанное деление, потребовалось разработать новый быстрый химический метод идентификации Z исследуемого элемента.Дело в том, что наблюдение спонтанного деления исключает возможность применения некоторых испытанных методов идентификации, например метода
двойной отдачи с последующим химическим выделением дочернего изотопа, так же как и методов, основанных на регистрации коррелированного α-распада (установление генетической связи между α-излучателями). Сильно осложняется измерение функции возбуждения селя спонтанно делящегося продукта при наличии фона. Уже в 1961 г. в Дубне было открыто явление спонтанного деления ядер, находящихся в изомерном состоянии. Изомеры америция с массовыми числами 240, 242 и 244 обладают периодами полураспада 0,6, 14 и 0,9 мс соответственно и с достаточно большим выходом образуются в сложных реакциях передачи при облучении кюрия, плутония и урана многозарядными ионами. Это обстоятельство в значительной степени затрудняло поиск и идентификацию изотопов 104-го элемента по эффекту спонтанного деления. Кроме того, за счет ядерных реакций неполного слияния типа (HI, α хn) возможен синтез изотопов 102-го элемента, которые имеют заметную долю распада путем спонтанного деления. Эти изотопы также являются источником фона, который необходимо учитывать в опытах по синтезу элемента 104.В 1964 г. в Дубне были проведены опыты по физической идентификации элемента 104. В качестве мишени был выбран
242Pu, а бомбардирующей частицы — 22Ne. В опытах использовались два варианта аппаратуры. Детекторами осколков спонтанного деления в обоих случаях служили фосфатные стекла с минимальным содержанием урана (меньше 10-8 г на 1 г стекла). Это было необходимым условием, поскольку детекторы располагались вблизи мишени, где нейтронный поток мог индуцировать деление примесей урана в стекле.Ядра-продукты реакций вбивались в материал сборников. Конвейерная лента-сборник в первом варианте протягивалась с большой скоростью вдоль стеклянных детекторов. По
распределению треков на детекторах можно было судить о периоде полураспада спонтанно делящегося изотопа.В другом варианте в качестве сборников использовались тонкие алюминиевые фольги (4—5 мкм), смонтированные на дисковом транспортере. Детекторы располагались по обе стороны сборников, что позволяло регистрировать два осколка, если деление испытывало ядро, находящееся в материале сборника. Фоновые треки в детекторе, обусловленные вынужденным делением примесей урана в стекле нейтронами, не давали
“совпадений”.При облучении
242Ри ионами 22Ne с энергией 114 МэВ был зарегистрирован спонтанно делящийся продукт с периодом полураспада 0,3 с. Для доказательства принадлежности этого эффекта 104-му элементу изучались функции возбуждения всех спонтанно делящихся ядер, наблюдавшихся в опытах.Функции возбуждения для образования 14-мс активности, 8-с активности, а также для
256Fm имели вид нарастающих с энергией кривых, и только функция возбуждения для активности с T1/2=0,3 с имела характерный “испарительный” максимум при энергии ионов 22Ne примерно 114 МэВ.Совокупность всех данных по сечениям ядерных реакций (
HI, xn) указывала, что изотоп с Т1/2=0,3 с с наибольшей вероятностью образуется в ядерной реакции (22Ne, 4n), и поэтому авторы приписали зарегистрированную активность изотопу 260104. Однако обращал на себя внимание тот факт, что сечение образования 0,3-с активности имело достаточно малую величину (~2•10-34 см2) по сравнению с расчетной для реакции (22Ne, 4n) на основании известных данных по Гn/Гt в этой области ядер. Известно, что положение максимумов и ширины функций возбуждения для (22Ne, 3n)-, (22Ne, 4n)- и (22Ne, 5n)-реакций не очень сильно отличаются, и поэтому нельзя исключить, что обнаруженная активность с T1/2=0,3 с полностью или частично обусловлена синтезом и распадом 26ll04 или 259104 или наложением эффектов от спонтанного деления обоих изотопов. Сечение реакции с испарением трех нейтронов действительно должно быть меньше сечения реакции с испарением четырех нейтронов, а в случае реакции (22Ne, 5n) кажущееся уменьшение сечения может быть обусловлено частичным вкладом спонтанного деления в общем процессе распада изотопа 259104.Дополнительным аргументом принадлежности 0,3-с активности 104-му элементу служило отсутствие ее в продуктах реакции при облучении
238U ионами 22Ne и 242Рu ионами 20Ne, тогда как при этом четко наблюдался, например, Am242m (T1/2=14 мс).Понимая важность химической идентификации для доказательства факта синтеза нового элемента и принимая во внимание то обстоятельство, что для химической идентификации нового элемента значение массового числа не имеет значения, в лаборатории ядерных реакций (Дубна) было решено продолжить опыты по изучению 104-го элемента с привлечением экспрессной хроматографии в газовой фазе.
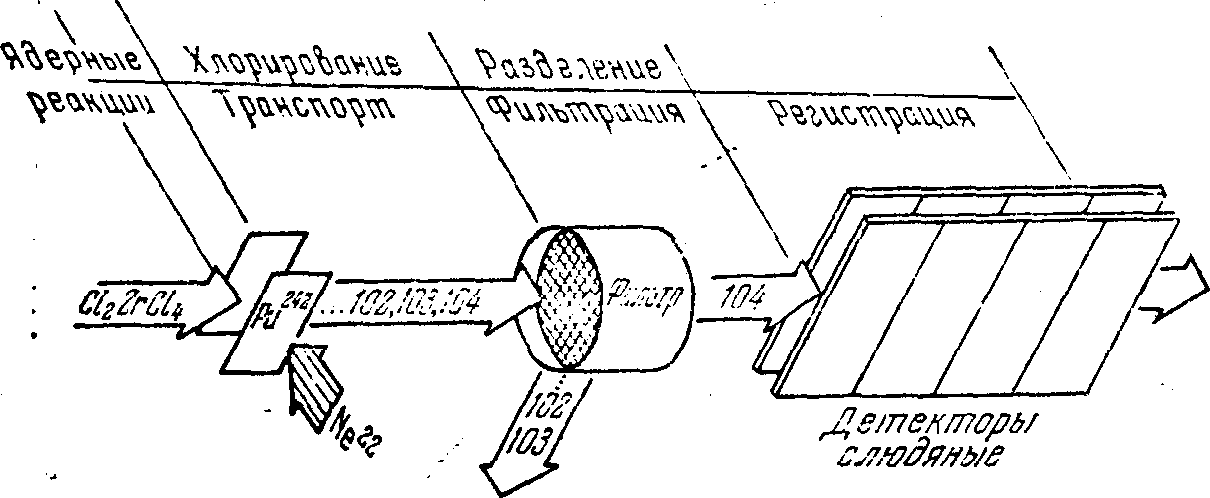
Рис.
2. Схема эксперимента для выделения и изучения химических свойств короткоживущих изотопов методом газовой химииСоответствующая аппаратура в течение нескольких лет разрабатывалась в лаборатории Зварой с сотрудниками. К 1965 г. вариант для внутреннего пучка 310-см циклотрона был готов к работе, а в 1966—1967 гг. был создан другой вариант для выведенного пучка ускорителя. Схема аппаратуры показана на рис. 2. Принцип ее действия основан на резком различии в летучести элементов IIIб и IVб подгрупп (температура возгонки HfCl4 равна 315°С, в то время как трихлориды лантаноидов кипят при температуре выше 1500° С). Атомы отдачи тормозились в газовом потоке азота, к которому добавлен хлорирующий агент, одновременно являющийся и носителем для 104-го элемента (например, пара ZrCl4 или NbCl5). В качестве детекторов использовалась предварительно отожженная слюда. В камере детекторов в общей сложности наблюдалось около 80 осколков спонтанного деления изотопа с Т1/2≈0,3 с с выходом, находящимся в хорошем согласии с данными физических опытов. Одновременно, а также в последующих опытах было показано, что хлориды редкоземельных элементов, а также калифорния, фермия, 102-го и 103-го элементов практически не проходили в камеру детекторов, и лишь хлориды гафния и изотопа с Т1/2≈0,3 с без потерь в газовом тракте и на фильтрах проникали в область регистрации радиоактивного распада. Следовательно, излучатель с Т1/2≈0,3 с образует легколетучие соединения с хлором, т. е. является аналогом гафния и принадлежит к IV группе периодической системы элементов. Таким образом, независимые химические эксперименты подтвердили его принадлежность 104-му элементу.
Авторы физической и химической работ предложили назвать 104-й элемент курчатовием (символ Кu) в знак признания выдающихся заслуг академика И. В. Курчатова в развитии ядерной физики”.
Таким образом, приоритет СССР (России) в открытии элементов с номерами от 102 и выше не вызывает сомнения. Однако начиная с некоторого времени этот приоритет оспаривается. Например, в 1997 г
. на очередном съезде IUPAC были приняты дискриминационные решения в отношении дубненских атомщиков. Остановимся на об этом подробнее.Вначале приведем перевод материала
IUPAC “Наименования новых элементов (рекомендации IUPAC 2002 года)”. Англоязычный текст дан на сайте IUPAC, мы же даем его русский перевод. В начале упомянем, кто входит в комиссию, которая дает названия элементам: это 14 членов комиссии, 5 ассоциированных членов, а также национальные представители. В разные годы эти представители представляли следующие страны (приводим только страны, фамилии опускаем): Австралия, Индия, Словакия, Южная Корея, Швеция, Бразилия, Венгрия, Великобритания, ЮАР, Россия, Турция, Финляндия, Новая Зеландия, Израиль, Япония, еще раз Швеция, Польша, Нидерланды, еще раз ЮАР. Подчеркну, что это не те страны, которые представлены в IUPAC, а те, которые в разные периоды времени были представлены там. Например, Россию в 1994-1997 гг. представлял В. Колотов, сейчас не представляет никто.Итак, обратимся к тексту
:“Предметом статьи является процедура предложения новых названий элементов. После того, как открытие нового элемента установлено объединенной рабочей группой
IUPAC-IUPAP2, первооткрывателям предлагается дать вариант названия и символа в отдел неорганической химии IUPAC.…1. Введение
…В идеале, элемент или соединение должны иметь уникальное название, поскольку разночтения в названиях одного и того же вещества могут приводить к конфузу.
Примером является случай, когда элемент 104 в течение трех десятилетий по вине конкурирующих лабораторий имел два названия – резерфордий и курчатовий. Корень проблемы – в уверенности открывателей, что они единственные, кто может давать название элементу. Однако в соответствии с решением IUPAC 1947 г. первооткрыватели могут лишь предложить IUPAC имя, и только комиссия IUPAC по неорганической номенклатуре после проверки предложенного названия устанавливает, подходит ли оно, и публичного компетентного рассмотрения может дать рекомендации Совету IUPAC. … Если для названий ряда элементов происхождение неясно, то названия других были основаны на свойствах элемента, минерала, в котором он содержался, места или территории открытия, мифологических образов и представлений, названиях астрономических объектов или были названы в честь выдающихся ученых.
2. Существующие рекомендации
Недавние споры по названиям трансфермиевых элементах основывались на трех источниках:
1) приоритете открытия;
2) праве первооткрывателя предложить название
;3) роли комиссии
IUPAC по номенклатуре неорганических соединений. Эти основания были впервые изложены в 1947 году”.В цитируемом документе об этом говорится так:
“
В 1947 году конференция IUPAC в Лондоне решила, что в будущем названия элементов и все вопросы, связанные с названиями и символами, должны распределяться на объединенных собраниях комиссии по химической номенклатуре и атомным массам. Эти вопросы предварительно согласовываются только с комиссией по атомным массам.В прошлом было принято, что первооткрыватели новых элементов имеют монопольное право давать им названия. Однако иногда одному и тому же элементу давались два названия, в связи с чем часто бывает трудно решить, какое из них было в действительности дано первым. Более того, названия, которые были даны позже, оказывались более общеупотребительными, чем те, которые были даны первыми, и такие случаи были отмечены в международной таблице атомных масс, поэтому принятие названия такого элемента не может быть основано на приоритете открытия. Приоритет – это только фактор, учитываемый в принятии решения о том, какое название лучше для международного употребления. Это презумпционное право номенклатурной комиссии
IUPAC связано в первую очередь с поиском названий для новых элементов, произведенных искусственно”.Право открывателей предложить названия новых элементов было утверждено в 1990 году:
“
Элементы с атомными номерами более 103 часто упоминаются в научной литературе, но получают название только после своего открытия. Этим элементам необходимы названия даже до того, как их существование будет установлено, и следовательно IUPAC предложил систематическую номенклатуру и серию трехбуквенных символов для атомов таких элементов.Существование такой номенклатуры не зачеркивает права первооткрывателей новых элементов предложить
IUPAC другие названия после того, как их открытие будет несомненно установлено научным сообществом”.Приведенные цитаты показывают, что ранее:
-
открыватели новых элементов имели право предложить их названия;-
комиссии IUPAC по номенклатуре неорганических соединений было дано предпочтительное право проверять эти названия и совершать публикации и обзоры, чтобы определить их пригодность перед тем, как предложить их Совету IUPAC для реализации;-
приоритет открытия может, но не обязан быть принят во внимание.Возникает законный вопрос, почему последнее из этих правил всегда срабатывало не в нашу пользу
?Однако продолжим цитирование
:“
…Выявление приоритета применяется только по отношению к вновь открытым элементам. В случае, если приоритет открытия был изменен, то такой элемент не переименовывается.3. Выбор названий для новых элементов
Согласно традиции, элементы называют по имени:
- мифологической концепции или символов (включая астрономические объекты)
;- минерала или подобного вещества
;- территории или географического объекта
;- свойства элемента
;- имени ученого
.Чтобы избежать конфузов в литературе после выбора окончательного названия элемента его другие, неофициальные названия, если таковые есть, не могут быть использованы для другого элемента.
Пример является случай с элементом 105, для которого неофициально использовалось название
“ганий”. После того, как для этого элемента было выбрано название “дубний”, название “ганий” не может быть использовано для какого-либо другого элемента”.Если мы правильно это перевели, то получается, что никто не имел права переносить название
“резерфордий” со 103 элемента на 104, а название “нильсборий” – со 105 на 107. Тем не менее IUPAC нарушил свои же правила.Но вернемся к тексту документа:
“
Что касается лингвистической конструкции, названия всех новых элементов должны заканчиваться на “-ий” (“-ium”).4. Процедура наименования нового элемента
4.1.
Формальное предложение названияКогда существование нового элемента неопровержимо установлено объединенной рабочей группой IUPAC-IUPAP, об этом информируются авторы открытия и отдел неорганической химии IUPAC. В течение двух месяцев после получения отчета от объединенной группы IUPAC-IUPAP президент ICD3 предлагает авторам открытия предложить название и символ для утверждения. Предложение должно соответствовать установленным правилам. Если такого предложения не поступило в течение шести месяцев после приглашения, ICD берет на себя инициативу процесса. Подобным образом она поступает, если группа открывателей или лабораторий не достигли согласия по названию и символу в течение шести месяцев после приглашения: ICD также берет инициативу на себя.
4.2. Проверка ICD и публичные обзоры
ICD будет проверять предложенные название и символ на пригодность и в случае согласия передает эти предложения согласно процедуре, утвержденной IUPAC. Она, если кратко, включает в себя рассылку рекомендаций 15 экспертам, учреждениям и другим заинтересованным органам, Международному комитету по номенклатуре и символам, национальным и региональным центрам и заинтересованным индивидуалам. Запрашивается также мнение IUPAC. Если при этом возникнут сложности, которые сделают предложенное название неприемлемым, тогда ICD связывается с лабораторией (лабораториями) на предмет их согласия на какие-либо изменения либо на альтернативное название.
4.3. Формальное наименование элемента
Когда эти процедуры завершены, президент ICD пересылает финальные рекомендации ICD по названию нового элемента в Совет IUPAC для формального утверждения Советом и публикации в официальном органе IUPAC – журнале “Pure and Applied Chemistry”
4.4
. Предварительные названияДо и во время процесса наименования элемент можно называть по его атомному номеру, например “элемент 118”, или в соответствии с предложенным систематическим названием, “унуноктиум”. Если символ необходим, используется трехбуквенный символ”.
А теперь дополним этот текст нашими комментариями.
Данный обзор не касался вопроса, откуда вообще берутся предлагаемые, а впоследствии утверждаемые названия элементов. Если мы сопоставим названия элементов и время их открытия, то по принципам, которые использовались для их названий, все элементы можно четко разделить на три группы:
1) элементы, открытые в период с глубокой древности до середины XVIII века
;2) элементы, открытые с XVIII века по 1957 г
.;3) элементы, открытые с 1957 г
. по настоящее время.Элементы первой группы хотя и имеют официальное название (как правило, латинское), тем не менее в каждом из языков называются по-своему, при этом установить происхождение каждого из названий – как международного (латинского), так и национальных – весьма затруднительно. Всего таких элементов 11 (перечисляются в порядке роста атомного номера): сера, железо, медь, мышьяк, серебро, олово, сурьма, золото, ртуть, свинец и висмут.
Вторая самая многочисленная группа – это те элементы, которые были названы в точном соответствии с изложенными рекомендациями
IUPAC и названия которых однозначны, всеми приняты и не оспариваются. Информацию о том, что конкретно означает название каждого из этих элементов, можно найти в сетевой версии данного материала по адресу avtarkia.html.Элементы 3-й группы (от 102-го и выше) – это те, по названиям которых либо до сих пор идут споры, либо те, давать названия которым не спешат.
Итак, в три разных исторических периода существовало три разных подхода к названиям элементов. Если внимательно посмотреть, то причина возникновения этих подходов – не в головах ученых, а в практической деятельности людей.
Например, те 11 элементов, которые относятся к первой из названных групп, были известны еще в самые древние времена, и каждый из народов, который научился выплавлять, скажем, медь или железо, давал этому металлу свое название. Понятия
“химический элемент” в те времена еще не было, и названия этим элементам давались по всем тем лингвистическим законам, по каким давались названия и всем другим вещам. Этом подход изменился на рубеже XVIII–XIX веков, когда в науке утвердилось понятие “химический элемент” и все известные на тот момент вещества были идентифицированы либо как элементы, либо как сложные вещества, состоящие из элементов.Когда понятие
“элемент” было введено в науку, элементы стали открывать, причем в отличие от предыдущей группы сначала открывали, а потом искали практическое применение (скажем, германий и уран ждали практического применения в течение 100 лет после их открытия). Ранее у простых элементов не было своего первооткрывателя: их “открывали” все те, кто использовал в практическом производстве. Теперь же у каждого элемента есть свой первооткрыватель (даже если один элемент открывали два и более разных исследователя, то всегда можно зафиксировать приоритет), значит, был и субъект, правомочный давать название.До 1950-х годов новые элементы именно открывали (сначала в природе, потом в ядерном реакторе). Начиная с менделевия и далее элементы уже не открывают, а производят в ускорителях. Здесь и причина разногласий – по спирали диалектического развития мы вернулись к первому этапу: кто производит вещество, тот и называет его так, как ему удобнее. И старые правила
IUPAC, которые были идеальны для названий большинства элементов, теперь приходят в затруднение.Заметьте, что попирать советский (российский) авторитет в синтезе элементов 102-107 начали ровно с 1991 г. Причина здесь не только и не столько в том, что власти, пришедшие в 1991 г
., стали угождать Западу и оплевывать все советское (хотя и этот фактор сыграл немалую роль), а в том, что из-за экономических проблем Дубна в 1991-1998 гг. прекратила активность, в итоге вперед вырвались немцы и притихшие было американцы (с 1998 г. Дубна начала брать реванш).Как конкретно попирался советский приоритет, можно проследить по всем элементам на основе данных табл. 2.
Таблица 2
Как оспаривается наш приоритет в открытии новых элементов
|
Элемент |
Как было на самом деле |
Как это преподносится с 1991 г . |
|
102 |
Результаты Нобелевского института от 1957 г . не были подтверждены в СССР и США. Первые изотопы были синтезированы в СССР в 1963-1967 гг., впоследствии американцы их подтвердили |
Результаты Нобелевского института признаны законными. Утверждено название “нобелий”, данное этим институтом |
|
103 |
Синтез был произведен сотрудниками Г. Н. Флёрова в Дубне в 1965-1967 гг., чуть позже был синтезирован в США. Американцы в журнале “The Physical Review” (август 1971 г.) были вынуждены признать, что “элемент номер 103 впервые был синтезирован в Дубне” |
Утверждено название “лоуренсий”, данное американцами |
|
104 |
Элемент был синтезирован в Дубне в 1964 г. Американцы сумели синтезировать 104-й элемент только через несколько лет |
IUPAC утверждает, что будто бы “открытие элемента 104 оспаривается Дубной и Беркли” |
|
105 |
Элемент был синтезирован в Дубне в 1967 г. В Беркли он был синтезирован только через 2 месяца. Советский приоритет зафиксирован документально (см. Ежегодник БСЭ, 1971 г .) |
IUPAC утверждает, что будто бы “открытие элемента 105 оспаривается Дубной и Беркли” |
|
106 |
“ В начале 1974 г. атомщики Дубны зарегистрировали при такой бомбардировке 50 случаев, указывающих на образование 106-го элемента, который, однако, распадается уже через 10-2 с. Эти 50 атомных ядер образовались по схеме: 208Pb+51Cr=259X.Немного позднее Гиорсо и Сиборг из лаборатории Лоуренса в Беркли сообщили, что они синтезировали изотоп нового 106-го элемента с массовым числом 263 путем обстрела калифорния-249 ионами кислорода в аппарате Super-HILAC.Какое имя будет носить новый элемент? Откинув прежние разногласия, группы в Беркли и Дубне, соперничающие в научном соревновании, пришли на этот раз к единому мнению. О названиях говорить еще рано, сказал Оганесян ” (из книги К. Хоффмана “Можно ли сделать золото”) |
Из заявления IUPAC: “Открытие элемента 106 в Беркли бесспорно, и название, предложенное первооткрывателями – сиборгий – утверждено” |
|
107 |
Элемент синтезирован в Дубне в 1976 г ., а в Дармштадте – в 1981 (из книги Г. Н. Флёрова “На пути к сверхэлементам”) |
Из заявления IUPAC: “107 элемент открыт совместно Дармштадской и дубненской лабораториями” |
В общем-то понятна причина такого выбора названий: Курчатов – создатель советской атомной бомбы, поэтому не вписывается в
“новый мировой порядок”. А Фредерик Жолио-Кюри, именем которого назван элемент жолиотий, мало того, что был членом ЦК французской компартии (что американцы, может быть, еще и стерпели бы), но еще и борцом за мир, что согласно современному американскому законодательству приравнено к мировому терроризму. Потому не удивительно, что именно после 1991 г. IUPAC занялась переписыванием истории науки.Еще раз обратим ваше внимание на пункт из рекомендаций
IUPAC, в котором говорится, что во избежание “конфузов в литературе” после утверждения окончательного названия элемента, существовавшие до этого другие, неофициальные названия не могут быть использованы для названия другого элемента.Итак, даже неофициальные названия элемента нельзя переносить на другой элемент. Скажем, есть элемент 103. Мы называли его резерфордием, а американцы – лоуренсием.
IUPAC предпочла название “лоуренсий”. И теперь никто не имеет права давать название “резерфордий” другому элементу, тем более курчатовию! Иначе не обижайтесь, если мы дадим название “дубний” элементу, который будет поинтереснее 105-го.Приоритет нашей страны в рассматриваемой области станет общепризнанным, если дело синтеза новых элементов (в первую очередь долгоживущих изотопов элементов
“острова относительной стабильности”) поставить на “промышленное” производство. Да, для этого нужны деньги, намного превышающие имеющиеся сегодня. Но затраты окупятся: даже сейчас, еще не имея в руках образцов “сверхэлементов”, можно предсказать их область применения.Для элемента 114 и ему подобных (речь идет не о нынешних
“30-секундных” изотопах, а об изотопах типа 298-го, которые, по прогнозам, могут жить миллиарды лет) - это ядерная энергетика (возможности энергетики на таких элементах были упомянуты в начале статьи). Тут может быть множество применений: от компактных мобильных реакторов до… оружия. В фантастической литературе описывались “калифорниевые пули” (критическая масса делящихся изотопов калифорния – несколько граммов), но в жизни это не реализуемо: каждую такую пулю пришлось бы носить в защитной оболочке размером с хороший сейф (потому что нейтроны, испускаемые калифорнием, поглощались бы атомами всех окружающих предметов, вызывая искусственную радиоактивность). А на 114-м все значительно легче реализуется. Или вы считаете, что у нашей страны больше нет внешних врагов?Есть гипотеза, что возможен еще один
“остров относительной стабильности” в районе 164-го элемента (заметьте, что 4 подряд особо устойчивых элемента – олово, свинец, 114-й и 164-й – все относятся к одной и той же подгруппе таблицы Менделеева. Вероятность случайного совпадения – единица на 50 тысяч. Впрочем, этому явлению имеется простое объяснение: как распределение электронов по оболочкам, так и распределение нуклонов по ядерным оболочкам регулируется одним и тем же принципом запрета Паули). Если такой “остров” существует, то, как утверждается, при таких размерах ядро атома неизбежно начнет притягивать нижние электроны с орбиты – то есть будет господствовать такой тип радиоактивного распада, как электронный захват. Но если будет синтезировано ядро без электронной оболочки – то такой “неполноценный” атом окажется более устойчивым. Получаем потрясающее явление: ядерные свойства элемента зависят от его химического состояния! Более того, такие “сверх-сверхтяжелые элементы” – это уже будет как бы переходный этап от химических элементов как таковых к неким большим концентратам нуклонов (предельным случаем которых являются нейтронные звезды). И тут, как это не смешно, вопрос о названиях элементов потеряет смысл, поскольку понятие “химический элемент” будет размыто. Будут говорить: ядро с меняющимся зарядом 217-223 и массой 950 (цифры условные). Будет как в астрономии, где звезды фигурируют в каталогах под номерами, и только наиболее яркие имеют свои названия.Если под эти проекты будут выделены и реализованы средства, то можно было бы предположить, что полномочия
IUPAC переместятся в Дубну, но боюсь уподобиться Остапу Бендеру с его Нью-Васюками. Но то, что тогда не IUPAC, и не Беркли, и не Дармштадт, а именно Россия станет центром притяжения для ученых и других работников высокотехнологичных отраслей – это несомненно.Поэтому открытые элементы должны получить названия, данные их первооткрывателями: 102 – жолиотий (Jl), 103 – резерфордий (Rf), 104 – курчатовий (Ku), 105 – нильсборий (Ns). Думается,
было бы логичным принять на соответствующих уровнях решения о том, чтобы в учебной, научной и научно-популярной литературе, издаваемой на территории России, элементы 102Jl, 103Rf, 104Ku, 105Ns назывались согласно данным им первооткрыватели именами.Предвижу возражение
, что ядерная физика интернациональна, и такая замена названий может вызвать разнобой, ибо в научной литературе используются названия 102No, 103Lr, 104Rf, 105Db. Однако, например, в английской литературе натрий и калий фигурируют под названиями “содий” и “потассий”, а бериллий в ряде стран называют “глициний”, что не вызывает ни у кого серьезного дискомфорта.Предлагаем также сотрудникам группы Ю.
Оганесяна, открывшим элементы 112, 114 и 116, своевременно предложить названия для этих элементов, пока нас не опередили конкуренты из Беркли и Дармштадта. Так, название “дубний” (Db), которого лишается 105-й элемент, предлагается дать элементу 114 – центру “острова относительной стабильность”. Ученые предлагают увековечить память Г. Н. Флёрова, назвав “флеровием” (Fl) элемент 116. А для того, чтобы быстрее покончить с практикой использования символа Lr (или Lw) для обозначения 103-го элемента, предлагается присвоить этот символ элементу 112, назвав его “Лаврентий” в честь создателя советской атомной промышленности Л. П. Берия. Конечно, могут возразить, что для этого у него слишком одиозная репутация. Оценки политической деятельности Берия, действительно, крайне неоднозначны, однако его определяющую роль в создании нашей ядерной науки никто не может отрицать.Предвижу еще одно возражение против этого предложения
: “незаконные” названия - 102No, 103Lr, 104Rf, 105Db – признаны всем научным сообществом, зарегистрированы в IUPAC, а автор этой статьи кто такой? В ответ предложу способы доказательства своей правоты.Таблица 3
|
Элемент |
Название |
Ориентировочная масса наиболее устойчивого изотопа |
|
101 |
Менделевий |
259-263 |
|
102 |
Жолиотий |
262-265 |
|
103 |
Резерфордий |
266-268 |
|
104 |
Курчатовий |
268-271 |
|
105 |
Нильсборий |
271-274 |
|
106 |
Сиборгий |
275-277 |
|
107 |
(Борий) |
277-280 |
|
108 |
(Гессий) |
280-282 |
Основание для такого вывода
- в статье, размещенной в Интернете по адресу: http://minspace.narod.ru/transuran.html. Если этот вывод подтвердится, то полагаю, что автор этой статьи будет иметь некоторое отношение к открытию новых изотопов этих элементов, и, соответственно, право голоса при решении вопроса об их названиях.2.
О способе доказательства. Как отмечено в статье Оганесяна, посвященной истории синтеза элементов 106-116, для этого необходимо научиться ускорять ионы урана (или аналогичной массы – 200-250 а.е.м.) до скоростей, достаточных для осуществления ядерных реакций.Согласно литературе, ныне действующие ускорители могут ускорять ионы с атомной массой лишь до 100 а.е.м. (как показано в той же статье
). Для ускорения более тяжелых ионов предлагается сконструировать ускоритель на основе открытого резонатора, математическая модель которого была разработана в дипломной работе автора в 2001 г. (скачать текст в формате PDF можно здесь). Поскольку данная дипломная работа имеет весьма узкую тему (описание нового способа ускорения частиц), то в нее не вошли разработанные в ходе подготовки диплома иные приложения данной ускорительной системы, например, “обратное” применение ускорителя – в качестве ионного реактивного двигателя, а также иных вытекающих отсюда приложений. Поскольку это выходит за рамки данной работы, дадим интересующимся лишь ссылку и добавим, что реализация этих предложений вполне окупит затраты по конструированию этого ускорителя.